-
铝是应用广泛的金属,以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料制备氧化铝的一种工艺流程如图。下列有关说法不正确的是( )
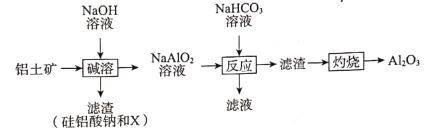
A.滤渣中X为Fe2O3
B.“反应”步骤中加入NaHCO3溶液后,溶液的pH增大
C.滤液中溶质的主要成分为Na2CO3
D.NaAlO2溶液呈碱性的原因:AlO2-+2H2O
Al(OH)3+OH-
难度: 中等查看答案及解析
-
下列生活常见用品中,有关物质的性质描述不正确的是( )
选项
生活用品
名称
主要成分
性质
A

PP塑料制作的奶瓶
聚丙烯
能够使酸性高锰酸钾褪色
B

肥皂
高级脂肪酸钠
肥皂的水溶液呈碱性
C

蜂蜜
葡萄糖、果糖和蔗糖
蔗糖在稀硫酸的作用下可水解生成葡萄糖和果糖
D

阿胶
驴的皮去毛后熬制而成的胶块
在合适的酶的作用下能够发生水解反应
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
化合物M是某合成农药的中间体,其结构为
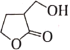 。下列有关的说法正确的是( )
。下列有关的说法正确的是( )A.M能发生取代反应和加成反应
B.1molM与足量的NaOH溶液反应,最多可消耗2molNaOH
C.分子中有5个碳原子共平面
D.同时含有-CHO和-COOH结构的M的同分异构体有5种(不含立体异构)
难度: 中等查看答案及解析
-
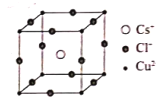
R、X、Y、Z、W是五种短周期主族元素,原子序数依次增大,其中X、Y、Z同周期,R、W与X、Y、Z不在同一周期,它们可组成某种离子化合物的结构如图所示。下列说法不正确的是( )
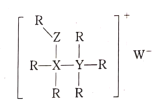
A.原子半径:X>Y>Z>R
B.氢化物的沸点:Z>Y>X
C.X、Y、Z、R可形成多种既能与盐酸反应,又能与NaOH反应的化合物
D.管道工人可用YR3检验输送W2的管道是否泄露
难度: 中等查看答案及解析
-
下列实验中,依据实验操作及现象得出的结论正确的是( )
选项
操作
现象
结论
A
将少量BaSO4固体用饱碳酸钠溶液浸泡,过滤后向滤渣中加入HCl
滤渣溶解,并产生气泡
Ksp(BaCO3)<Ksp(BaSO4)
B
足量双氧水滴入酸性高锰酸钾溶液中
溶液褪色
H2O2具有漂白性
C
向溶液X中通入氯化氢气体
生成白色沉淀
溶液X中一定含有Ag+
D
常温下,用pH计测定0.1mol•L-1NH4CN溶液的pH
pH=8.6
电离平衡常数:K(NH3•H2O)>K(HCN)
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
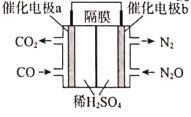
由于氯酸钠(NaClO3)具有吸湿性,不易保存,因此工业上常采用电渗析法将氯酸钠(NaClO3)转化成氯酸钾(KClO3),其工作原理如图所示(a、b两电极均为石墨电极,c、d、e依次为阳离子交换膜、阴离子交换膜、阳离子交换膜),下列法说不正确的是( )

A.a电极连接电源负极
B.左池NaOH溶液出口浓度大于入口浓度
C.该电解池的工作原理实质是电解水
D.制备1molKClO3,a、b两极共产生16.8L气体
难度: 简单查看答案及解析
-
已知:硫酸银(Ag2SO4)的溶解度大于氯化银且硫酸银(Ag2SO4)的溶解度随温度升高而增大,T℃时,Ag2SO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
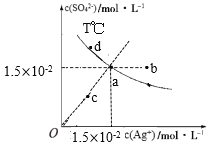
A.a点溶液加入硝酸银固体,则a点可沿虚线移动到b点
B.a点溶液若降低温度,则a点可沿虚线移动到c点
C.向a点的悬浊液中加入NaCl固体,溶液组成可能会由a向d方向移动
D.根据曲线数据计算可知,T℃下,Ksp(Ag2SO4)=2.25×10-4
难度: 中等查看答案及解析
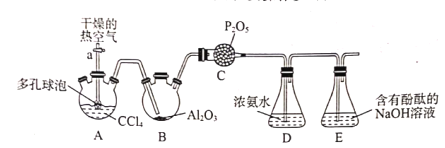
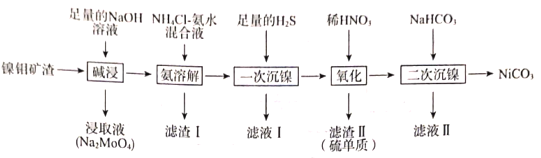
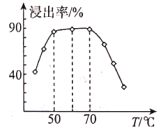
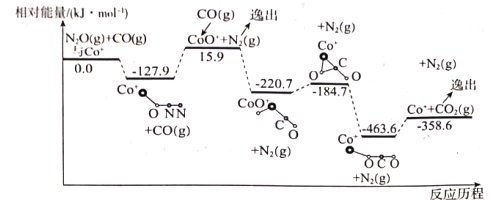

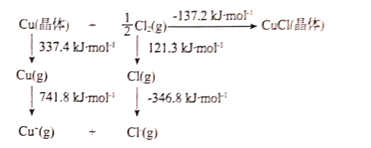
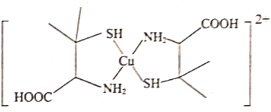
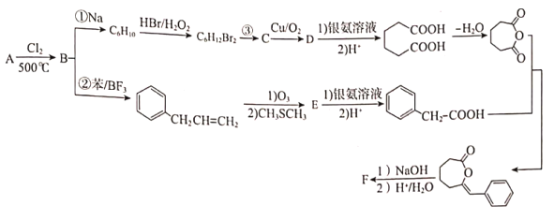
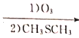 R-CHO+HCHO:
R-CHO+HCHO: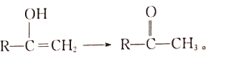
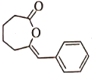 与NaOH反应的化学方程式为___。
与NaOH反应的化学方程式为___。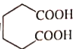 的同分异构体有多种,其中属于二元羧酸的同分异构体有___种(不含立体异构)写出其中核磁共振氢谱显示只有3组峰的同分异构体的结构简式:___。
的同分异构体有多种,其中属于二元羧酸的同分异构体有___种(不含立体异构)写出其中核磁共振氢谱显示只有3组峰的同分异构体的结构简式:___。