-
化学与生活密切相关。下列说法错误的是
A.将84消毒液和医用酒精混合使用,能更有效地杀死环境中的新冠病毒
B.医用外科口罩的核心功能层聚丙烯熔喷布属于有机高分子材料
C.疫苗必须冷藏存放,其目的是避免疫苗蛋白质变性
D.“丹砂(HgS)烧之成水银,积变又还成丹砂”。该过程不属于升华
难度: 中等查看答案及解析
-
关于化合物二苯基甲烷(
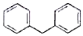 ),下列说法正确的是
),下列说法正确的是A.是苯的同系物 B.可以发生取代、加成、加聚反成
C.分子中所有原于可能共平面 D.一氯代物有4种
难度: 中等查看答案及解析
-
根据下列实验操作和实验现象所得出的结论错误的是
实验操作
实验现象
结论
A
向蔗糖中加入浓硫酸
蔗糖变成疏松多孔的海绵状炭,并放出有刺激性气味的气体
浓硫酸具有脱水性和强氧化性
B
向盛有H2O2溶液的试管中加入几滴酸化的硫酸亚铁溶液
溶液变成棕黄色,一段时间后溶液中出现气泡,随后有红褐色沉淀生成
Fe3+催化H2O2分解产生O2
C
铝片先用砂纸打磨,常温下再加入到浓硝酸中
无明显现象
常温下,铝不跟浓硝酸反应
D
向浓度均为0.01mol·L-1的KCl、KI的混合液中逐滴滴加稀AgNO3溶液
先出现黄色沉淀
Ksp(AgCl)>Ksp(AgI)
A.A B.B C.C D.D
难度: 困难查看答案及解析
-
已知NA是阿伏加德罗常数的值,下列说法正确的是
A.72gCaO2中阴离子数目为2NA
B.将0.1molCl2通入1L水中,转移的电子数为0.1NA
C.标准状况下,11.2LO2和22.4LNO在密闭容器中充分混合后,气体分子总数小于NA
D.室温下1LpH=13的NaOH溶液中,水电离出的OH-的数目为0.1NA
难度: 中等查看答案及解析
-
现有W、X、Y、Z四种短周期主族元素,其原子半径依次增大。W、X原子的最外层电子数相同,Y、Z两原子的原子序数之和与W、X两原子的核内质子数之和相等。Z与X形成的二元化合物的水溶液呈碱性。下列说法错误的是
A.四种元素中,W的非金属性最强,Z的金属性最强
B.由Z和W两种元素形成的化合物中一定只含有离子键
C.四种元素形成的简单离子中,X的半径最大,Y的半径最小
D.X、Y、Z的最高价氧化物对应的水化物相互之间能发生反应
难度: 中等查看答案及解析
-
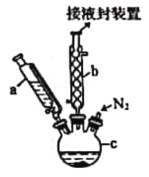
微生物燃料电池能将污水中的乙二胺(H2NCH2CH2NH2)氧化成环境友好的物质,示意图如图所示,a、b均为石墨电极。下列说法错误的是
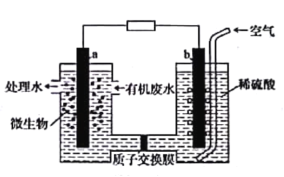
A.a电极的电极反应为H2NCH2CH2NH2-16e-+4H2O=2CO2↑+N2↑+16H+
B.电池工作时质子通过交换膜由负极区向正极区移动
C.a电极上的电势比b电极上的电势低
D.电池工作时b电极附近溶液的pH保持不变
难度: 中等查看答案及解析
-
常温下向一定浓度的Na2X溶液中滴入盐酸,粒子浓度与混合溶液的pH变化的关系如图所示,已知:H2X是二元弱酸,Y表示
或
,pY=-lgY。下列叙述错误的是
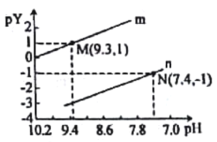
A.曲线n表示
与pH的变化关系
B.Ka1(H2X)=1.0×10-10.3
C.NaHX溶液中c(OH-)>c(H+)
D.当pH=7时,混合溶液中c(Na+)=c(HX-)+2c(X2-)+c(Cl-)
难度: 困难查看答案及解析
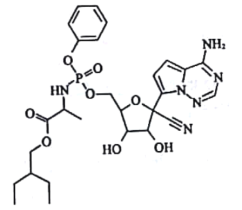
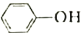 )是合成瑞德西韦的原料之一,其熔点为43℃,苯酚的晶体类型是________________。苯酚与甲苯(
)是合成瑞德西韦的原料之一,其熔点为43℃,苯酚的晶体类型是________________。苯酚与甲苯(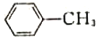 )的相对分子质量相近,但苯酚的熔、沸点高于甲苯,原因是________________。
)的相对分子质量相近,但苯酚的熔、沸点高于甲苯,原因是________________。
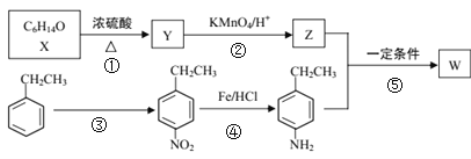
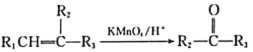 +R1COOH
+R1COOH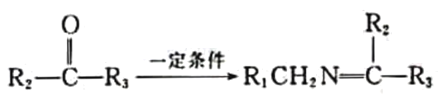 +H2O(R1、R2、R3代表烃基)
+H2O(R1、R2、R3代表烃基)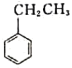 中___________(填“有”或“无”)手性碳原子,①的反应类型是___________。
中___________(填“有”或“无”)手性碳原子,①的反应类型是___________。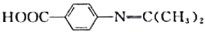 的合成路线:___________(无机试剂任选)。
的合成路线:___________(无机试剂任选)。