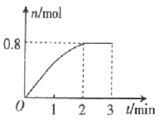
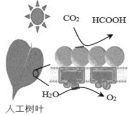
-
居室装修用的石材放射性的监测常用22688Ra作为标准,居里夫人因对Ra元素的研究两度获得诺贝尔奖。下列叙述中正确的是
A. 一个22688Ra原子中含有138个中子
B. Ra元素位于元素周期表中第六周期ⅡA族
C. RaCO3不能与盐酸反应
D. Ra(OH)2是一种两性氢氧化物
难度: 简单查看答案及解析
-
根据下表(部分短周期元素的原子半径及主要化合价)信息,下列叙述正确的是
元素代号
A
B
C
D
E
原子半径/nm
0.186
0.143
0.089
0.104
0.074
主要化合价
+1
+3
+2
+6、-2
-2
A.E2-与B3+的核外电子数不可能相等
B.离子半径大小A+<D2-
C.最高价氧化物对应水化物的碱性A<C
D.氢化物的稳定性D>E
难度: 困难查看答案及解析
-
化学科学需要借助化学专用语言描述,下列有关化学用语正确的( )
A.H2O的电子式:
B.中子数为8的碳原子:
C
C.CO2的比例模型:
D.Na+的结构示意图:
难度: 简单查看答案及解析
-
NA为阿伏加德罗常数,下列有关说法正确的是( )
A.用Fe、Cu和稀硫酸组成原电池,当负极质量减轻5.6g时,通过溶液的电子为0.2NA
B.标准状况下,2.24L三氯甲烷中含氢原子数为0.1NA
C.密闭容器中,2molSO2和1molO2充分反应后分子总数为2NA
D.11.6g丁烷中所含的非极性键数目为0.6NA
难度: 中等查看答案及解析
-
C5H12有3种不同结构,甲为CH3(CH2)3CH3,乙为CH3CH(CH3)CH2CH3,丙C(CH3)4,下列有关叙述正确的是( )
A.甲、乙、丙互为同系物,均可与氯气、溴蒸气发生取代反应
B.光照条件下,甲能与氯气反应生成2种一氯代物
C.甲、乙、丙中,丙的沸点最低
D.丙有3种二氯代物
难度: 简单查看答案及解析
-
短周期主族元素W、X、Y、Z的原子序数依次增大,Y和Z位于同一主族。m、n、p均为由这些元素组成的二元化合物,甲、乙、丙为其中三种元素对应的单质,丙为淡黄色固体,易溶在XZ2中,n是一种二元弱酸。上述物质的转化关系如图所示(反应条件省略)。下列说法正确的是
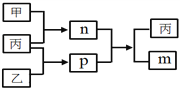
A. 原子半径:W<X<Y B. 非金属性:Y>Z>X
C. Y与Z组成的化合物一定有漂白性 D. W与X组成的化合物中只有极性键
难度: 困难查看答案及解析
-
N2和H2在催化剂表面合成氨的微观历程及能量变化的示意图如下,用
、
、
分别表示N2、H2、NH3,下列说法正确的是( )


A.使用催化剂,改变了反应的途径,使合成氨反应放出的热量减少
B.该过程中,N2、H2吸收能量后断键形成N原子和H原子
C.该过程中,N原子和H原子形成含有非极性键的NH3分子
D.合成氨反应中,反应物断键吸收能量大于生成物形成新键释放的能量
难度: 简单查看答案及解析
-
下列物质的一氯代物有两种,二氯代物有四种的是( )
A.CH3CH3 B.CH3CH2CH3 C.CH3CH2CH2CH3 D.(CH3)2CHCH3
难度: 简单查看答案及解析
-
可逆反应3Fe(s))+4H2O(g)= Fe3O4(s)+4H2(g)在容积可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
A.保持容器体积不变,加入水蒸气
B.将容器的容积缩小一半
C.保持容器容积不变,充入N2使体系压强增大
D.保持压强不变,充入N2使体系容积增大
难度: 简单查看答案及解析
-
下面是几种常见的化学电源示意图,有关说法不正确的是( )
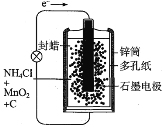


A.上述电池分别属于一次电池、二次电池和燃料电池
B.干电池在长时间使用后,锌筒被破坏
C.铅蓄电池工作过程中,每通过2mol电子,负极质量减小207 g
D.氢氧燃料电池中负极通入氢气发生氧化反应
难度: 中等查看答案及解析
-
厌氧氨化法是一种新型的氨氮去除技术,下列说法中正确的是( )
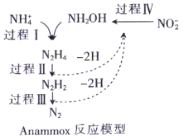
A.1molNH4+中所含的质子总数为10NA
B.1mol联氨(N2H4)中含有5mol共用电子对
C.NH2OH中既含有极性键也含有非极性键
D.该方法每处理1molNH4+,需要的NO2-为0.5mol
难度: 简单查看答案及解析
-
下列说法中正确的是( )
A.物质发生化学反应时都伴随能量变化,伴随能量变化的过程也一定是化学变化的过程
B.需要加热的化学反应一定是吸热反应,不需要加热就能进行的反应一定是放热反应
C.因为3O2=2O3是吸热反应,所以臭氧比氧气的化学性质更活泼
D.吸热反应就是反应物的总能量比生成物的总能量高;也可以理解为化学键断裂时吸收的能量比化学键形成时放出的能量多
难度: 简单查看答案及解析
-
一学生用如图装置研究原电池原理,下列说法错误的是( )
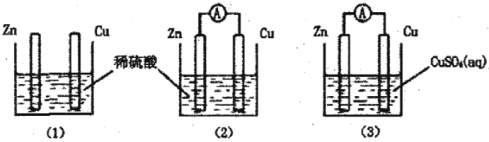
A.(2)图中电子由Zn沿导线流向Cu
B.(3)图中Zn片增重质量与Cu棒减轻质量比值为65∶64
C.(1)图中铜棒上没有气体产生
D.(2)图与(3)图中正极生成物质量比为1∶32时,Zn片减轻的质量相等
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.C6H14的同分异构体有5种
B.正戊烷和异戊烷属于同系物
C.CH4的二氯代物有相邻和相对两种同分异构体
D.光照条件下,1mol甲烷和氯气完全取代需要2mol氯气
难度: 中等查看答案及解析
-
下列有关实验现象或实验结论的说法不正确的是( )
A.
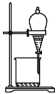 往KI溶液中加入新制氯水和CCl4,充分振荡、静置,液体分层,下层呈紫红色
往KI溶液中加入新制氯水和CCl4,充分振荡、静置,液体分层,下层呈紫红色B.
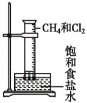 光照CH4和Cl2的混合气,量筒内液面上升,内壁附着油状液体,量筒内水溶液呈酸性
光照CH4和Cl2的混合气,量筒内液面上升,内壁附着油状液体,量筒内水溶液呈酸性C.
 往外拉动针筒活塞,观察水中玻璃导管口是否有气泡冒出,可检查装置气密性
往外拉动针筒活塞,观察水中玻璃导管口是否有气泡冒出,可检查装置气密性D.
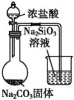 往烧瓶中滴入浓盐酸,根据实验现象,可判断盐酸、碳酸、硅酸的酸性强弱
往烧瓶中滴入浓盐酸,根据实验现象,可判断盐酸、碳酸、硅酸的酸性强弱难度: 中等查看答案及解析