-
化学与生活、社会发展息息相关。下列叙述正确的是
A.稀的食盐水能杀死 COVID-19 病毒
B.“世间丝、麻、裘皆具素质……”,这里丝、麻的主要成分是蛋白质
C.外形似海绵、密度小、有磁性的碳与石墨不再互为同素异形体
D.石油裂解的主要目的是得到更多的乙烯、丙烯等气态短链烃
难度: 简单查看答案及解析
-
扑热息痛是一种常用的解热镇痛药物,可通过下图路线合成。下列说法正确的是
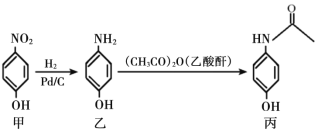
A.甲的苯环上的一氯代物有 2 种 B.乙的分子式为 C6H6NO
C.丙分子中的所有原子可能共面 D.由乙制备丙的反应类型为加成反应
难度: 简单查看答案及解析
-
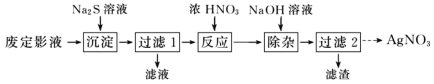
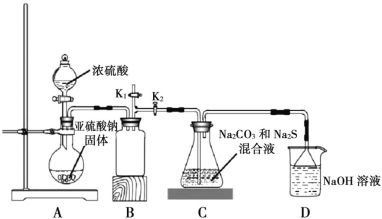
侯氏制碱法在我国工业发展中具有重要作用。现某学习小组在实验室中利用下列反应装置模拟侯氏制碱法制备 NaHCO3,反应原理为 NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl。下列说法正确的是
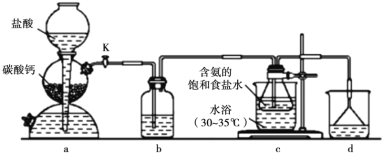
A.装置 a 中可改用碳酸钙粉末提高反应速率
B.装置 b、d 依次盛装饱和 Na2CO3 溶液、稀硫酸
C.装置 c 中含氨的饱和食盐水提高了 CO2 吸收效率
D.反应后将装置 c 中的锥形瓶充分冷却,蒸发结晶得到 NaHCO3 晶体
难度: 中等查看答案及解析
-
CO2 和 CH4 重整可制备合成气,催化重整反应历程示意图如下:
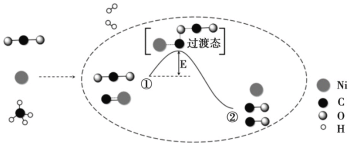
下列说法不正确的是
A.Ni 在该反应中做催化剂,参与化学反应
B.①→②吸收能量
C.①→②既有碳氧键的断裂,又有碳氧键的形成
D.合成气的主要成分为 CO 和 H2
难度: 简单查看答案及解析
-
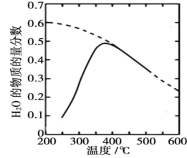
常温下向 100 mL 蒸馏水中滴入10 mL 5 mol·L-1HA溶液,利用传感器测得溶液中 c (H+)和温度随着加入 HA 溶液体积的变化曲线如图所示,下列有关说法正确的是
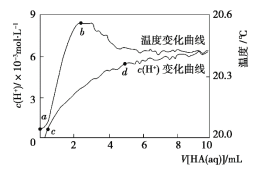
A.HA 是强酸
B.a ~ b 段,HA 电离放热,使溶液温度升高
C.c ~ d 段, c (H+)增大,HA 电离程度增大
D.c 点时,加入等体积等浓度的 NaOH 溶液,则 c (Na+)= c (A-)+ c (HA)
难度: 中等查看答案及解析
-
太阳能电池在日常生活中已广泛应用,一种替代硅光电池的全天候太阳能电池已投入商用,其工作原理如图。下列说法不正确的是()
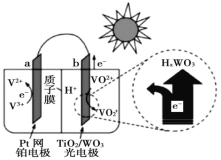
A.硅太阳能电池工作原理与该电池不相同
B.夜间时,该电池相当于蓄电池放电,a 极发生氧化反应
C.光照时,b 极的电极反应式为VO2+﹣e﹣+H2O=VO
+2H+
D.光照时,每转移 1mol 电子,有 2 mol H+ 由 b 极区经质子交换膜向 a 极区迁移
难度: 中等查看答案及解析
-
如图是一种新型离子化合物,该物质由两种阳离子和两种阴离子构成,其中有一种 18 电子离子和两种 10 电子离子。W、X、Y、Z 均为短周期元素,且均不在同一主族。下列说法不正确的是
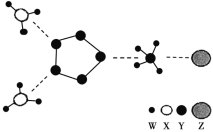
A.X 与 W 形成的化合物沸点高于 X 同族元素与 W 形成的化合物
B.Z 的最高价氧化物对应水化物的酸性比 Y 的强
C.Y 气态氢化物的稳定性比 X 的强
D.如图化合物中,存在极性共价键和非极性共价键
难度: 中等查看答案及解析