-
可燃冰是天然气与水相互作用形成的晶体物质,主要存在于冻土层和海底大陆架中。据测定每0.1m3固体“可燃冰”能释放出20m3甲烷气体,则下列说法中不正确的是( )
A.“可燃冰”释放的甲烷属于烃
B.“可燃冰”是水变油,属于化学变化
C.“可燃冰”将成为人类的后续能源
D.储量巨大的“可燃冰”的分解与释放,会诱发海底地质灾害,还会加重温室效应。
难度: 简单查看答案及解析
-
下列过程中,把化学能转化为热能的是( )
A.风力发电 B.干电池产生电流
C.木炭燃烧 D.用电取暖器取暖
难度: 简单查看答案及解析
-
反应A(g)+3B(g)
2C(g)+ 2D(g),在四种不同情况下用不同物质表示的反应速率分别如下,其中反应速率最大的是
A.v(C)= 0.04 mol /(L·S) B.v(B)= 0.06 mol /(L·min)
C.v(A)= 0.15 mol /(L·min) D.v(D)= 0.01 mol /(L·S)
难度: 简单查看答案及解析
-
据报导我国最近合成多种元素的新同位素,其中一种是
(铪),它的中子数是( )
A.72 B.113 C.185 D.257
难度: 简单查看答案及解析
-
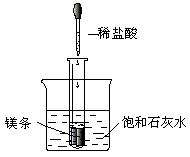
某金属能和盐酸反应生成氢气,该金属与锌组成原电池时,锌为负极,则该金属可能为
( )
A.铝 B.铜 C.锡 D.硅
难度: 简单查看答案及解析
-
可逆反应达到化学平衡的标志是( )
A.正、逆反应不再进行 B.反应物的浓度为零
C.正、逆反应都还在继续进行 D.正、逆反应的速率相等
难度: 简单查看答案及解析
-
下列反应原理中,不符合工业冶炼金属实际情况的是( )
A.2HgO
2Hg+O2↑ B.2Al+3MnO2
2Al2O3+3Mn
C.2MgO
2Mg+O2↑ D.4CO+Fe3O4
3Fe+4CO2
难度: 简单查看答案及解析
-
A、B、C都是金属,A中混有C时,A先腐蚀;A与B组成原电池时,A为电池的正极,则A、B、C三种金属的活动性顺序为 ( )
A.A>B>C B.A>C>B C.B>A>C D.B>C>A
难度: 简单查看答案及解析
-
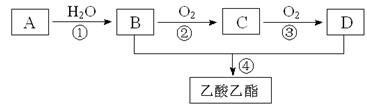
若甲烷与氯气以物质的量之比1:3混合,在光照下得到的产物:⑴CH3Cl, ⑵CH2Cl2,⑶CHCl3,⑷CCl4,其中正确的是 ( )
A.只有⑴ B.只有⑶
C.⑴⑵⑶的混合物 D.⑴⑵⑶⑷的混合物
难度: 简单查看答案及解析
-
下列关于物质性质变化的比较, 不正确的是 ( )
A.酸性强弱: HI > HBr > HCl > HF B.原子半径大小: Na > S > O
C.碱性强弱: KOH > NaOH > LiOH D.还原性强弱: F- > Cl- > I-
难度: 简单查看答案及解析
-
有a、b、c、d四种元素。a、b的阳离子与c、d的阴离子具有相同的电子层结构;a的阳离子的正电荷数小于b的阳离子的正电荷数,c的阴离子的负电荷数大于d的阴离子的负电荷数。则它们的离子半径的关系是 ( )
A.a>b>c>d B.c>d>a>b C.c>a>d>b D.b>a>d>c
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.由H形成1 mol H-H键要吸收热量
B.所有燃烧反应都是放热反应
C.16g O3单质中含有的分子个数为NA
D.凡经加热而发生的化学反应都是吸热反应
难度: 简单查看答案及解析
-
下图中a、b、c、d、e为周期表前4周期的一部分,下列叙述正确的是 ( )
A.b元素除0价外,只有一种化合价
B.五种元素中,c元素形成的单质性质最稳定
C.c、d元素最高价氧化物的水化物酸性:c > d
D.e元素在自然界中主要存在于海水中
难度: 简单查看答案及解析
-
在理论上可用于设计原电池的化学反应是( )
A.2Al(s)+2NaOH(aq)+2H2O(1) = 2NaAlO2(ag)+3H2(g) △H <0
B.Ba(OH)2·8H2O(s)+2NH4Cl(s)= BaCl2(aq)+2NH3·H2O(aq)+8H2O(l) △H >0
C.CaC2(s)+2H2O(1) = Ca(OH)2(s)+C2H2(g) △H <0
D.HCl(aq)+NaOH(aq) = NaCl(aq) + 3H2O(l) △H <0
难度: 简单查看答案及解析
-
在120℃时,某混合烃和过量O2在一密闭容器中完全反应,测知反应前后的压强没有变化,则该混合烃可能是 ( )
A.CH4和C2H4 B.CH4和C2H6 C.C2H4和C2H6 D.C3H4和C3H6
难度: 简单查看答案及解析
-
下列物质一定不是天然高分子的是 ( )
A.橡胶 B.蛋白质 C.聚乙烯 D.纤维素
难度: 简单查看答案及解析
-
某原电池总反应的离子方程式为2Fe3++Fe=3Fe2+,能实现该反应的原电池组成是( )
A.正极为铁,负极为铜,电解质溶液为FeCl3溶液
B.正极为碳,负极为铁,电解质溶液为Fe(NO3)3溶液
C.正极为铁,负极为锌,电解质溶液为Fe2(SO4)3溶液
D.正极为银,负极为铁,电解质溶液为CuSO4溶液
难度: 简单查看答案及解析
-
一种新型燃料电池,以镍板为电极插入KOH溶液中,分别向两极通乙烷和氧气,负极电极反应式为:C2H6+18OH-→2CO32-+12H2O+14e-,下列叙述中不正确的是( )
A.正极发生反应是:O2+2H2O+4e-→4OH-
B.参加反应的C2H6与O2的物质的量之比为7:2
C.放电一段时间后,KOH的物质的量浓度将下降
D.在电解质溶液中阳离子向正极移动
难度: 简单查看答案及解析