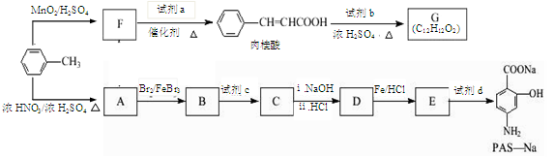
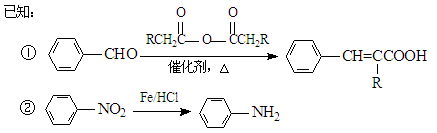
-
化学与环境、生活、材料密切相关。下列说法正确的是
A.安装煤炭燃烧过程的“固硫”装置,主要是为了提高煤的利用率
B.二氧化氯和三氯化铁都常用于自来水的处理,二者的作用原理是相同的
C.通过有机合成,可以制造出比钢铁更强韧的新型材料
D.气溶胶和液溶胶的差别在于分散质的物质状态
难度: 中等查看答案及解析
-
关于过氧化物的叙述正确的是(NA表示阿伏伽德罗常数)
A.7.8 g过氧化钠含有的共用电子对数为0.2NA
B.2H2O2(l)=2H2O(l)+O2(g) ΔH=−98.2 kJ·mol−1,ΔS=70.5 J·mol−1·K−1,该反应低温能自发进行
C.过氧化氢使高锰酸钾溶液褪色,1 mol过氧化氢得到2NA电子
D.在含有NH4+ 、Ba2+、Cl—、NO3—离子的溶液 加入少量过氧化钠以上各离子量几乎不减少
难度: 中等查看答案及解析
-
下表为截取的元素周期表前4周期的一部分,且X、Y、Z、R和W均为主族元素。下列说法正确的是
X
]
Y
Z
R
W
A.五种元素的原子最外层电子数一定都大于2
B.X、Z原子序数可能相差18
C.Z可能是氯元素
D.Z的氧化物与X单质不可能发生置换反应
难度: 困难查看答案及解析
-
物质中杂质(括号内为杂质)的检验、除杂的试剂或方法都正确的是
物质及其杂质
检验
除杂
A
Cl2(HCl)
湿润的淀粉KI试纸
饱和食盐水
B
NO(NO2)
观察颜色或湿润的淀粉KI试纸
水
C
CO2(HCl)
AgNO3溶液(含稀硝酸)
饱和Na2CO3溶液
D
NaHCO3溶液(Na2CO3)
Ca(OH)2溶液
过量CO2
难度: 中等查看答案及解析
-
卤素互化物与卤素单质性质相似。已知CH2=CH—CH=CH2(1,3—丁二烯)与氯气发生加成产物有三种:
①CH2Cl—CHCl—CH=CH2 (1,2—加成)
②CH2Cl—CH=CH—CH2Cl (1,4—加成)
③CH2Cl—CHCl—CHCl—CH2Cl(完全加成)
据此推测CH2=C(CH3)—CH=CH2(异戊二烯)与卤素互化物BrCl的加成产物有几种(不考虑顺反异构和镜像异构
A.6种 B.10种 C.12种 D.14种
难度: 困难查看答案及解析
-
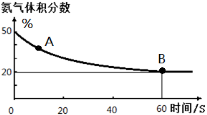
常温下,0.2 mol/L的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是
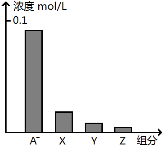
A.HA为强酸
B.该混合液pH=7
C.图中X表示HA,Y表示OH-,Z表示H+
D.该混合溶液中:c(A-)+c(Y)=c(Na+)
难度: 困难查看答案及解析
-
某混合溶液中,含溶质X、Y各0.1 mol,向其中滴加0.1 mol/L的Z溶液,所得沉淀的物质的量如下图,则符合条件的X、Y、Z分别是
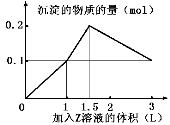
A.氯化铝、 氯化铁、 氢氧化钠
B.氯化铝、 氯化镁、 氢氧化钠
C.偏铝酸钠、 氯化钡、 硫酸
D.偏铝酸钠、 氢氧化钡、 硫酸
难度: 困难查看答案及解析