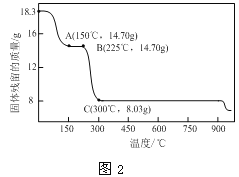
-
下列变化不属于化学变化的有几项
①用铁质容器盛放浓硝酸 ②给装有氯化铵的试管加热,在管口又有白色晶体产生 ③液氮用作制冷剂 ④ 明矾用作净水剂 ⑤碳酸钠晶体的风化 ⑥用氢氟酸刻蚀石英制艺术品 ⑦二氧化氮气体遇冷颜色变浅
A. 0 B. 1 C. 2 D. 3
难度: 中等查看答案及解析
-
下列有关元素化合物的说法正确的有
① 某酸雨样本放置一段时间后,pH 由4.68变为428,是因为水中溶解了较多的CO2
② 二氧化硅既能与NaOH溶液反应,也与氢氟酸反应,所以二氧化硅属于两性氧化物
③ 氯水、二氧化硫的水溶液滴在蓝色石蕊试纸上,均是先变红后褪色
④ 食盐可作调味剂,也可作食品防腐剂
⑤ 将适量SO2和CO2分别通入BaC12、CaC12、Ba(NO)2溶液中,均无白色沉淀生成
⑥ SiO2制成的玻璃纤维,由于导电能力强而被用于制透通讯光缆
⑦ 足量的镁与浓硫酸或浓硝酸反应,均生成混合气体
⑧ 铁盐水解时产生具有吸附性的胶体较子,可以用于饮用水的杀菌消毒
⑨ 利用高纯硅的半导体性能,可以制成光电池
⑩ 灼烧某物质时,用眼直接观察到火焰呈黄色,则可判断该物质不含钾元素
A. 1 句 B. 2 句 C. 3 句 D. 4 句
难度: 困难查看答案及解析
-
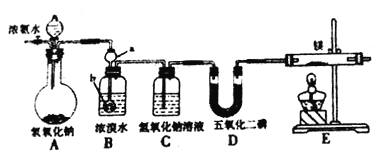
如图是课外活动小组的同学设计的4个喷泉实验方案,下列有关操作不可能引起喷泉现象的是
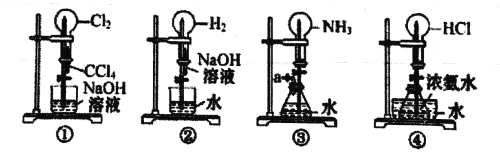
A. 挤压装置①的胶头滴管使CCl4全部进入烧瓶,片刻后打开止水夹
B. 挤压装置②的胶头滴管使NaOH溶液全部进入烧瓶,片刻后打开止水夹
C. 用鼓气装置从装置③的a处不断鼓入空气并打开止水夹
D. 向装置④的水槽中慢慢加入足量浓硫酸并打开止水夹
难度: 中等查看答案及解析
-
下列各组物质中,满足表中图示物质在一定条件下一步转化关系的组合有
序号
X
Y
Z
W
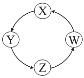
①
Si
Na2SiO3
H2SiO3
SiO2
②
Na
NaOH
Na2CO3
NaCl
③
Cl2
Ca(ClO)2
HClO
HCl
④
Fe
FeCl3
FeCl2
Fe(OH)2
A. ①②③ B. ①③④ C. ②③ D. ②③④
难度: 困难查看答案及解析
-
充分加热如图所示的密闭容器中放置有固体试剂的两个位置, 若钠与氧化银均反应完全且恢复到原来的温度,U形管左右两侧液面相平。下列有关说法中错误的是
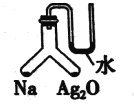
A. 反应前后装置内空气的成分保持不变
B. 反应前装置内钠与Ag2O物质的量之比为2:1
C. 热稳定性:生成的钠的氧化物强于Ag2O
D. 反应后有淡黄色固体生成
难度: 困难查看答案及解析
-
向CuSO4溶液中逐滴加入KI溶液至过量,观察到产生白色沉淀CuI,蓝色溶液变为棕色。再向反应后的溶液中通入过量的SO2气体,溶液变成无色。则下列说法正确的是
A. 通入22.4 L SO2参加反应时,有2 NA个电子发生转移
B. 通入SO2后溶液逐渐变成无色,体现了SO2的漂白性
C. 滴加KI溶液时,KI被氧化,CuI是氧化产物
D. 上述实验条件下,物质的氧化性:Cu2+>I2>SO2
难度: 中等查看答案及解析
-
氰(CN)2的结构简式为N≡C—C≡N,其化学性质与卤素(X2)很相似,化学上称之为拟卤素,其氧化性介于Br2和I2之间。下列有关反应的化学方程式不正确的是( )
A. (CN)2+H2=2HCN
B. MnO2+4HCN=Mn(CN)2+(CN)2↑+2H2O
C. 向KCN溶液中加入碘水:I2+2KCN=2KI+(CN)2
D. 在NaBr和KCN混合液中通入少量Cl2:Cl2+2KCN=2KCl+(CN)2
难度: 中等查看答案及解析
-
各取n mol的Na、Mg、Al分别与含有lmol HCl的盐酸反应,若Mg和Al产生氢气的物质的量相等且大于钠产生氢气的物质的量,则n的取值范围是
A. n>1 B. n=1 C. 0.5≦n<1 D. n<0.5
难度: 中等查看答案及解析
-
建构数学模型来研究化学问题,既直观又简洁,下列建构的数轴模型正确的是( )
A.钠在氧气中燃烧,钠的氧化产物:
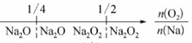
B.铁在Cl2中燃烧,铁的氧化产物:
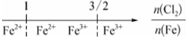
C.A1C13溶液中滴加NaOH溶液后体系中铝元素的存在形式:
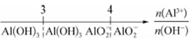
D.FeI2溶液中通入Cl2,铁元素存在形式:
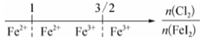
难度: 中等查看答案及解析
-
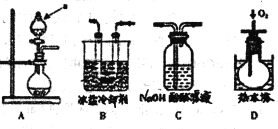
如图装置,将溶液A逐滴加入固体B中,下列叙述正确的是
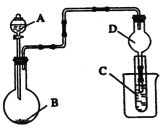
A. 若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液褪色
B. 若A为质量分数为70%的浓硫酸,B为NaSO3固体,C中盛石蕊试液,则C中溶液先变红后褪色
C. 若a为浓氮水,B为生石灰,C中盛AlCl3溶液,则C中先产生白色沉淀后沉淀又溶解
D. 若A为醋酸,B为贝壳,C中盛过量澄清石灰水,则C中溶液变浑浊
难度: 中等查看答案及解析
-
下列离子方程式中书写正确的有几项
① FeS固体与稀硝酸混合:FeS + 2H+ = Fe2++H2S
② 用过量氨水吸收烟道气中的SO2:SO2+2NH3·H2O =SO32-+2NH4++H2O
③ 将少量SO2气体通入NaClO溶液中:SO2+2ClO-+H2O=SO32-+2HClO
④ 已知Ka1(H2CO3)> Ka(HClO)> Ka2(HCO3-),向NaClO溶液中通入少量CO2:2ClO-+CO2+H2O=2HClO+CO32-
⑤ 铁屑溶于足量稀硝酸:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O
⑥ 氯气溶于水:Cl2+H2O=2H++Cl-+ClO-
⑦ 实验室用NH4Cl和Ca(OH)2制氨气:NH4++OH-
NH3↑+H2O
⑧ 向NH4Al(SO4)2溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O
⑨ 实验室制Cl2:4HCl(浓)十MnO2
Mn2++2Cl-+Cl2↑+2H2O
⑩ FeCl3溶液刻蚀铜制电路板:Fe3+ +Cu = Fe2+ + Cu2+
A. 1 项 B. 2 项 C. 3 项 D. 4 项
难度: 困难查看答案及解析
-
下列示意图与对应的反应情况正确的是
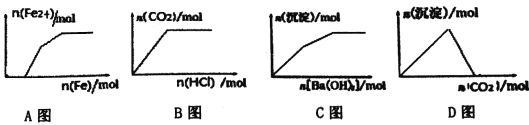
A. Fe(NO3)3、Cu(NO3)2、HNO3混合溶液中逐渐加入铁粉
B. Na2CO3、NaHCO3溶液中逐滴加入HCl
C. KAl(SO4)2溶液中逐滴加入Ba(OH)2 溶液
D. NaAlO2溶液中逐渐通入CO2
难度: 困难查看答案及解析
-
设NA代表阿伏加德罗常数,下列说法正确的是
A. KClO3+6HCl=KCl+3Cl2↑+3H2O中,生成13.44L(标准状况)Cl2转移电子效为l.2NA
B. 标准状况下,11.2L NO和11.2L O2混合后,原子总数小于2NA
C. 足量的MnO2与一定量的浓盐酸反应得到lmol C12,若向反应后的溶浓中加入足量的AgNO3,则生成AgCl的物质的量为2mol
D. 5.6g Fe与一定量的稀硝酸反应,转移电子数可能为0.26NA
难度: 困难查看答案及解析
-
某无色溶液含有下列离子中的若干种:H+、NH4+、Fe3+、Ba2+、Al3+、CO32-、Cl-、OH-、NO3-。向该溶液中加入铝粉,只放出H2,则溶液中能大量存在的离子最多有
A. 4 种 B. 5 种 C. 6 种 D. 7 种
难度: 困难查看答案及解析
-
下列实脸操作、现象和结论均正确的是
实验操作
现象
结论
A
溶有SO2的BaCl2溶液中通入气体X
有白色沉淀产生
X一定是Cl2
B
将过量的过氧化钠投入滴有酚酞试液的水中
最终得红色溶液
过氧化钠与水反应生成碱性物质
C
铝丝用砂纸打磨后,放在冷的浓硝酸中浸泡一段时间后,放入CuSO4溶液中
铝丝表面变红色
铝可从铜盐溶液中置换出铜
D
将KI溶液和FeCl3溶液在试管中混合后,加入CCl4,振荡,静置
下层溶液显紫红色
氧化性:Fe3+>I2
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
向一定量的NaOH溶液中逐滴加入AlCl3溶液,生成沉淀Al(OH)3的量随AlCl3加入量的变化关系如图所示。 则下列离子组在对应的溶液中一定能大量共存的是
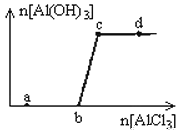
A. a点对应的溶液中:Na+、Fe3+、SO42- 、HCO3-
B. b点对应的溶液中:Na+、S2-、SO42- 、Cl-
C. c点对应的溶液中:Ag+、Ca2+、NO3-、F-
D. d点对应的溶液中:K+、NH4+、I-、HCO3-
难度: 困难查看答案及解析
-
中学常见物质A、B、C、D、E、X,存在下图转化关系(部分生成物和反应条件略去)。下列推断不正确的是
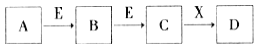
A. 若D是一种白色沉淀,在空气中最终变为红褐色,则A可能是铁
B. 若D是一种强碱,则A、B、C均可与X反应生成D
C. 若D为NaCl,且A可与C反应生成B,则E可能是CO2
D. 若D是一种强酸,则A既可以是单质,也可以是化合物,且D可与铜反应生成B或C
难度: 中等查看答案及解析
-
将一定量的氯气通入300 mL 浓度为lmol/L的NaOH 溶液中恰好完全反应,加热少许时间后溶液中形成NaCl、NaClO及NaClO3的共存体系.下列判断不正确的是
A. n(Na+):n(C1-)可能为7:3
B. n(NaCl):n(NaClO):n(NaClO3)可能为11:1:2
C. 参加反应氯气物质的量为0.15mol
D. 反应中转移电子物质的量n的范围:0.15mol<n<0.25mol
难度: 困难查看答案及解析
-
常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到20mL lmol/L的NaOH 溶液,然后用lmol/L的盐酸滴定,测得生成沉淀的质量与消耗盐酸的体积关系如图所示,则下列说法正确的是
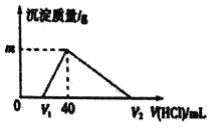
A. 原合金质量为0.92g
B. 图中V2的值为60mL
C. 产生氢气的体积为1120mL
D. 图中m的值为1.56g
难度: 困难查看答案及解析
-
1.52g铜镁合金完全溶解于5mL 14mol/L的浓硝酸中,得到NO2和N2O4的混合气体1120 mL (标准状况),向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54g 沉淀.下列说 法不正确的是
A. 该合金中铜与镁的物质的量之比是2:l
B. 得到2.54g 沉淀时,加入NaOH 溶液的体积是600mL
C. NO2和N2O4的混合气体中,NO2的体积分数是80%
D. 与铜镁合金反应的HNO3的物质的量为0.12mol
难度: 困难查看答案及解析