-
用如图所示的实验装置,选择适当的试剂B并进行如下实验,可以达到目的的是

A.试剂B为浓硫酸,除去CO2中混有的少量SO2气体
B.试剂B为饱和食盐水,除去氯气中混有的少量氯化氢气体
C.试剂B为水,收集NO、CO等难溶于水的气体
D.试剂B为新制氢氧化铜悬浊液,检验空气中是否含有甲醛
难度: 简单查看答案及解析
-
乙苯催化脱氢制苯乙烯反应:

下列说法中不正确的是( )
A. 乙苯的一氯代物共有3种不同结构
B. 苯乙烯和氢气生成乙苯的反应属于加成反应
C. 苯乙烯分子中所有原子有可能位于同一平面上
D. 等质量的苯乙烯和聚苯乙烯燃烧耗氧量相同
难度: 中等查看答案及解析
-
下列实验现象描述正确的是( )
A. 碘水中加入少量汽油振荡,静置后上层颜色变浅,下层颜色变为紫红色
B. 红热的铜丝在氯气中燃烧,产生棕黄色的烟雾
C. 原电池工作时,正极表面一定有气泡产生
D. 溴化钠溶液中加入少量新制的氯水振荡,再加入少量四氯化碳振荡,静置后上层颜色变浅,下层颜色变为橙红色
难度: 中等查看答案及解析
-
关于微粒在指定溶液中能否大量共存的评价正确的是( )
选项
溶液
微粒
评价
A
8%H2O2水溶液
Fe3+、Mg2+、SO
、Na+
可以大量共存
B
室温下pH=12的水溶液
NO、Na+、SO
、K+
NO能将SO
氧化而不能大量共存
C
1 mol·L-1的NH4Cl溶液
Ba2+、OH-、NH3·H2O
NH4Cl溶液显酸性,
NH3·H2O不能大量共存
D
NaHSO4水溶液
I-、K+、CH3COO-、Br-
CH3COO-能与NaHSO4溶液反应,不能大量共存
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列关于铁及其化合物的说法正确的是( )
A. 将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,观察溶液是否变红,可以检验Fe(NO3)2晶体是否已氧化变质
B. 浓氨水中滴加FeCl3饱和溶液可制得Fe(OH)3胶体
C. 1 mol FeI2与足量氯气反应时转移的电子数为2NA
D. 水溶液中Fe2+、H+、SO
、ClO-不能大量共存
难度: 中等查看答案及解析
-
相同体积、相同pH的某一元强酸溶液①和某一元中强酸溶液②分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是( )

A. A B. B C. C D. D
难度: 中等查看答案及解析
-
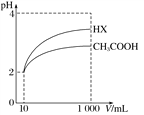
pH=2的两种一元酸x和y,体积均为100 mL,稀释过程中pH与溶液体积的关系如下图所示。分别滴加NaOH溶液(c=0.1 mol·L-1)至pH=7,消耗NaOH溶液的体积为Vx、Vy,则 ( )

A. x为弱酸,Vx<Vy B. x为强酸,Vx>Vy
C. y为弱酸,Vx<Vy D. y为强酸,Vx>Vy
难度: 困难查看答案及解析
-
将0.1 mol·L-1的下列物质的水溶液,从常温加热到90 ℃,溶液的pH几乎不变的是(不考虑水的蒸发)( )
A. 氯化钠 B. 氢氧化钾 C. 硫酸 D. 硫酸铵
难度: 中等查看答案及解析
-
实验室现有3种酸碱指示剂,其pH变色范围为:甲基橙:3.1~4.4 石蕊:5.0~8.0 酚酞:8.2~10.0。用0.100 0 mol·L-1 NaOH溶液滴定未知浓度的CH3COOH溶液,反应恰好完全时,下列叙述中正确的是( )
A. 溶液呈中性,可选用甲基橙或酚酞作指示剂 B. 溶液呈中性,只能选用石蕊作指示剂
C. 溶液呈碱性,可选用甲基橙或酚酞作指示剂 D. 溶液呈碱性,最好选用酚酞作指示剂
难度: 中等查看答案及解析
-
常温下两种不同浓度的NaOH溶液,c(H+)分别为1×10-13 mol·L-1和1×10-10 mol·L-1。将此两溶液等体积混合后,所得溶液中的c(H+)是( )
A. 1×(10-14+10-10) mol·L-1 B.
mol·L-1
C. 2×10-13 mol·L-1 D. 2×10-14 mol·L-1
难度: 中等查看答案及解析
-
有关pH计算结果一定正确的是( )
①强酸pH=a,加水稀释到10n倍,则pH=a+n
②弱酸pH=a,加水稀释到10n倍,则pH<a+n(a+n<7)
③强碱pH=b,加水稀释到10n倍,则pH=b-n
④弱碱pH=b,加水稀释到10n倍,则pH>b-n(b-n>7)
A. ①② B. ②③ C. ③④ D. ②④
难度: 中等查看答案及解析
-
由反应物X转化为Y和Z的能量变化如图所示。下列说法正确的是( )
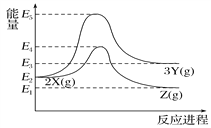
A. 由X→Y能量减小量=E5-E2
B. 由X→Z能量增大
C. 降低压强有利于提高Y的产率
D. 升高温度有利于提高Z的产率
难度: 中等查看答案及解析
-
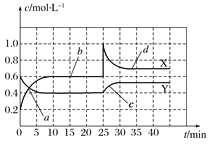
在密闭容器中进行反应:X(g)+3Y(g)
2Z(g),有关下列图像的说法不正确的是( )

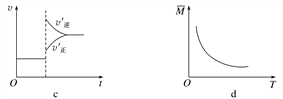
A. 依据图a可判断正反应为放热反应
B. 在图b中,虚线可表示使用了催化剂
C. 若正反应的ΔH<0,图c可表示升高温度使平衡向逆反应方向移动
D. 由图d中混合气体的平均相对分子质量随温度的变化情况,可推知正反应的ΔH>0
难度: 中等查看答案及解析
-
活性炭可处理大气污染物NO,反应原理:C(s)+2NO(g)
N2(g)+CO2(g)。T ℃时,在2 L密闭容器中加入0.100 mol NO和2.030 mol活性炭(无杂质),平衡时活性炭物质的量是2.000 mol。下列说法不合理的是( )
A. 该温度下的平衡常数:K=
B. 达到平衡时,NO的转化率是60%
C. 3 min末达到平衡,则v(NO)=0.01 mol·L-1·min-1 D. 升高温度有利于活性炭处理更多的污染物NO
难度: 中等查看答案及解析
-
H2S水溶液中存在电离平衡H2S
H++HS-和HS-
H++S2-。若向H2S溶液中 ( )
A. 加水,平衡向右移动,溶液中氢离子浓度增大
B. 通入过量SO2气体,平衡向左移动,溶液pH值增大
C. 滴加新制氯水,溶液pH值减小
D. 加入少量硫酸铜固体(忽略体积变化),溶液中所有离子浓度都减小
难度: 中等查看答案及解析
-
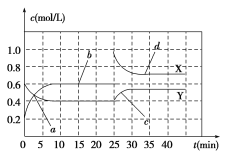
一定条件下存在反应C(s)+H2O(g)
CO(g)+H2(g):向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示。下列说法正确的是( )
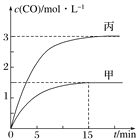
容器
甲
乙
丙
容积
0.5 L
0.5 L
V
温度
T1 ℃
T2 ℃
T1 ℃
起始量
2 mol C
1 mol H2O
1 mol CO
1 mol H2
4 mol C
2 mol H2O
A. 甲容器中,反应在前15 min的平均速率v(H2)=0.1 mol·L-1·min-1
B. 丙容器的体积V>0.5 L
C. 当温度为T1 ℃时,反应的平衡常数K=2.25
D. 乙容器中,若平衡时n(H2O)=0.4 mol,则T1<T2
难度: 困难查看答案及解析
-
室温下向10 mL 0.1 mol·L-1NaOH溶液中加入0.1 mol·L-1的一元酸HA,溶液pH的变化曲线如图所示。下列说法正确的是( )

A. a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA)
B. a、b两点所示溶液中水的电离程度相同
C. pH=7时,c(Na+)=c(A-)+c(HA)
D. b点所示溶液中c(A-)>c(HA)
难度: 中等查看答案及解析
-
室温下,将0.05 mol Na2CO3固体溶于水配成100 mL溶液,向溶液中加入下列物质,有关结论正确的是( )
加入物质
结论
A
50 mL 1 mol·L-1H2SO4
反应结束后,c(Na+)=c(SO
)
B
0.05 mol CaO
溶液中
 增大
增大C
50 mL H2O
由水电离出的c(H+)·c(OH-)不变
D
0.1 mol NaHSO4固体
反应完全后,溶液pH减小,c(Na+)不变
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
一定温度下,下列溶液的离子浓度关系式正确的是( )
A. pH=5的H2S溶液中,c(H+)=c(HS-)=1×10-5 mol·L-1
B. 1 L且n均为0.1 molCH3COOH、CH3COONa混合溶液中c(CH3COO-)+c(OH-)=0.1 mol·L-1
C. pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+c(H+)=c(OH-)+c(HC2O)
D. pH相同的①CH3COONa,②NaHCO3,③NaClO三种溶液的c(Na+):①>②>③
难度: 困难查看答案及解析
-
下列有关电解质溶液中粒子浓度关系正确的是( )
A. pH=1的NaHSO4溶液:c(H+)=c(SO
)+c(OH-)
B. NaHSO3溶液中c(Na+)>c(HSO)>c(OH-)>c(H+)。
C. CO2的水溶液:c(H+)>c(HCO)=2c(CO
)
D. 含等物质的量的NaHC2O4和Na2C2O4的溶液:3c(Na+)=2[c(HC2O)+c(C2O
)+c(H2C2O4)]
难度: 中等查看答案及解析