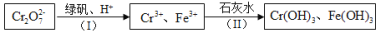-
生活中处处有化学,下列有关说法正确的是( )
A.草木灰与铵态氮肥不能混合施用与盐类水解有关
B.焊接时用NH4Cl溶液除锈与盐类水解无关
C.明矾水解时产生具有吸附性的胶体粒子,可作漂白剂
D.生活中Cl2和NaOH制取消毒液,运用了盐类的水解原理
难度: 中等查看答案及解析
-
下列关于热化学反应的描述中正确的是
A.HCl和NaOH反应的中和热△H=-57.3 kJ·mol−1,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ·mol−1
B.甲烷的标准燃烧热ΔH=-890.3 kJ·mol−1,则CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH<-890.3 kJ·mol−1
C.已知:500℃、30MPa下,N2(g)+3H2(g)
2NH3(g) ΔH=-92.4kJ·mol-1;将1.5 mol H2和过量的N2在此条件下充分反应,放出热量46.2 kJ
D.CO(g)的燃烧热是283.0kJ·mol−1,则2CO2(g) ===2CO(g)+O2(g)反应的△H=+566.0 kJ·mol−1
难度: 中等查看答案及解析
-
关于反应进行方向的判断,以下说法错误的是( )
A.高锰酸钾加热分解是一个熵增的过程
B.△H<0的化学反应均是自发反应,△S<0的化学反应均不能自发进行
C.能自发进行的化学反应不一定是△H<0、△S>0
D.反应2Al2O3(s)+3C(s)=2Al(s)+3CO2(g)在常温下不能自发进行,说明该反应△H>0
难度: 中等查看答案及解析
-
下列事实不能用勒夏特列原理解释的是
A.氯水中存在平衡:Cl2 + H2OH++ Cl- + HClO,当加入适量 NaHCO (s)后,溶液颜色变浅
B.在 K2Cr2O7溶液中存在如下平衡:Cr2O72- + H2O2CrO42- + 2H+,若向 K2Cr2O7溶液中滴入 5~15 滴浓硫酸,溶液颜色加深
C.对于反应体系 CO(g) + NO2(g) NO(g) + CO2(g),给平衡体系增大压强可使颜色变深
D.对于反应 2NO2(g)N2O4(g)△H < 0,平衡体系升高温度颜色变深
难度: 中等查看答案及解析
-
常温下,下列各组离子一定能在指定溶液中大量共存的是( )
A.使酚酞变红色的溶液中:Na+、Al3+、
、Cl-
B.与Al反应能放出H2的溶液中:Fe2+、K+、
、
C.
=1×10-13mol/L的溶液中:
、Ca2+、Cl-、
D.水电离的c(H+)=1×10-13mol/L的溶液中:K+、Na+、
、
难度: 中等查看答案及解析
-
常温下,pH=13的强碱溶液与pH=2的强酸溶液混和,所得混和溶液的pH=11,则强碱与强酸的体积比是( )
A.9:1 B.11:1 C.1:11 D.1:9
难度: 简单查看答案及解析
-
常温下,将一定量的氨基甲酸铵置于密闭真空容器中(固体体积忽略不计)发生反应:H2NCOONH4(s)
2NH3(g)+CO2(g)△H,达到平衡时测得c(CO2)=amol·L-1。温度不变,达到平衡后压缩容器体积至原来的一半,达到新平衡时测得c(NH3)=xmol·L-1。下列说法正确的是( )
A. 混合气体的平均相对分子质量不再变化时表明达到平衡状态
B. 达到新平衡时,△H为原来的2倍
C. 上述反应达到新平衡状态时x=2a
D. 上述反应体系中,压缩容器体积过程中n(H2NCOONH4)不变
难度: 困难查看答案及解析
-
25℃时,水的电离达到平衡:H2O=H++OH-,下列叙述正确的是( )
A.
表示的粒子不会对水的电离平衡产生影响
B.
表示的物质加入水中,促进水的电离,c(H+)增大
C.25℃时,CH3COO-加入水中,促进水的电离,Kw不变
D.水的电离程度只与温度有关,温度越高,电离程度越大
难度: 中等查看答案及解析
-
对于可逆反应:A2(g)+3B2(g)
2AB3(正反应放热),下列图象中正确的是
A.
B.
C.
D.
难度: 困难查看答案及解析
-
物质的量浓度相同的以下溶液:①NH4HSO4②(NH4)2CO3③NH4Fe(SO4)2④NH4NO3⑤NH4HCO3,c(NH
)由大到小的顺序为( )
A.②①③④⑤
B.③①④②⑤
C.①③④⑤②
D.①④②⑤③
难度: 简单查看答案及解析
-
常温下,用0.1000 mol·L-1 NaOH溶液滴定20.00 mL 0.1000 mol·L-1 CH3COOH溶液所得滴定曲线如下图。下列说法正确的是
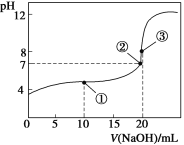
A.点①所示溶液中:c(CH3COO-)+c(OH-)=c(Na+)+c(H+)
B.点②所示溶液中:c(Na+)=c(CH3COOH)+c(CH3COO-)
C.点③所示溶液中:NaOH与CH3COOH恰好完全中和,溶液呈中性
D.在0.1000 mol·L-1 CH3COOH溶液中,由水电离出来的c(H+)= 10-13 mol·L-1
难度: 中等查看答案及解析
-
已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13,Ksp(Ag2CrO4)=9×10-11。某溶液中含有Cl-、Br-和CrO
,浓度均为0.010mol/L,向该溶液中逐滴加入0.010mol/L的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为( )
A.Cl-、Br-、CrO
B.CrO
、Br-、Cl-
C.Br-、Cl-、CrO
D.Br-、CrO
、Cl-
难度: 中等查看答案及解析
-
下列说法中正确的是
A.常温下,稀释0.1 mol/L的氨水,溶液中c(OH-)、c(
)、c(H+)均减小
B.常温下,c(
)相等的①(NH4)2SO4、②(NH4)2Fe(SO4)2、③NH4Cl、④(NH4)2CO3溶液中,溶质物质的量浓度大小关系是:②<①<④<③
C.pH相等的CH3COONa、NaHCO3和Na2CO3三种溶液:c(CH3COONa)<c(NaHCO3)<c(Na2CO3)
D.某温度时水的离子积常数KW=10-13,若将此温度下pH=11的NaOH溶液aL与pH=1的稀硫酸bL混合,若所得混合液pH=2,则a∶b=2∶9
难度: 中等查看答案及解析
-
下列指定反应的离子方程式书写正确的是
A.向次氯酸钠溶液中通入少量二氧化碳:2ClO- + CO2+H2O =2HClO+CO32- (已知电离常数:H2CO3 :Ka1 = 4.4×10-7、Ka2= 4.7×10-11;HClO:K=2.9×10-8)
B.金属钠与水反应:2Na + 2H2O = 2Na++ 2OH-+ H2↑
C.硫酸铝溶液中加入过量氨水:Al3+ + 3OH-= Al(OH)3↓
D.硫代硫酸钠(Na2S2O3)溶液与稀硫酸反应:Na2S2O3 + 2H+= 2Na+ + S↓+ SO2↑+ H2O
难度: 困难查看答案及解析
-
如图所示是碳酸钙(CaCO3)在25 ℃和100 ℃两种情况下,在水中的溶解平衡曲线。下列有关说法正确的是
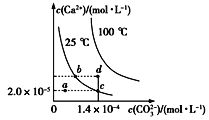
A.CaCO3(s)
Ca2+(aq)+ CO32-(aq) ΔH<0
B.a、b、c、d四点对应的溶度积Ksp相等
C.温度不变,蒸发水,可使溶液由a点变到c点
D.25 ℃时,CaCO3的Ksp=2.8×10-9
难度: 中等查看答案及解析
-
已知常温时HClO的Ka=3.0×10-8,HF的Ka=3.5×10-4。现将pH和体积都相同的次氯酸和氢氟酸溶液分别加蒸馏水稀释,pH随溶液体积的变化如图所示。下列叙述正确的是( )
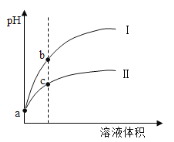
A.曲线I为次氯酸稀释时pH变化曲线
B.b点溶液中水的电离程度比c点溶液中水的电离程度小
C.a点时,若都加入相同大小的锌粒,此时与氢氟酸反应的速率大
D.取a点的两种酸溶液,中和相同体积、相同浓度的NaOH溶液,消耗次氯酸的体积较小
难度: 中等查看答案及解析