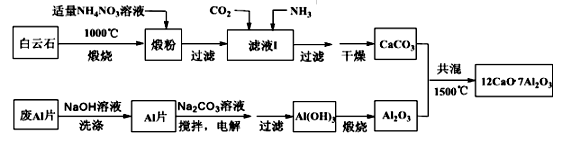
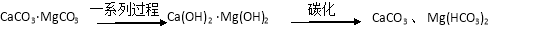-
化学与生活密切相关,下列说法不正确的是
A.甘油可作护肤保湿剂
B.无水氯化钙可用作食品干燥剂
C.包装用材料聚乙烯和聚氯乙烯都属于烃
D.使用含钙离子浓度较大的地下水洗衣服,肥皂去污能力减弱
难度: 简单查看答案及解析
-
甲苯的苯环上有5个氢原子,若其中两个氢原子分别被羟基和氯原子取代,则可形成的有机物同分异构体有
A.9种 B.10种 C.12种 D.15种
难度: 困难查看答案及解析
-
原子序数依次递增的4种短周期元素可形成简单离子W2-、X+、Y3+、Z2-,下列说法不正确的是
A.工业上常采用电解法冶炼Y单质
B.气态氢化物的稳定性:H2W强于H2Z
C.离子半径由大到小:Z2->X+>Y3+>W2-
D.W、X形成的化合物中阴、阳离子个数比一定是1:2
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法错误的是
A.标准状况下,18gH2O中含有的质子数为10NA
B.标准状况下,2.24LCl2通入水中,反应转移的电子数为0.1NA
C.常温常压下,53.5gNH4Cl晶体中含有共价键的数目为4NA
D.常温常压下,2L0.5 mol•L﹣1硫酸钾溶液中阴、阳离子总数大于3NA
难度: 困难查看答案及解析
-
下列现象或事实不能用同一原理解释的是
A.浓硝酸和氯水用棕色试剂瓶保存
B.Na2S和Na2SO3固体长期暴露在空气中变质
C.Cl2和SO2都能使品红溶液褪色
D.SO2和Na2SO3溶液都能使溴水褪色
难度: 中等查看答案及解析
-
室温时,将浓度和体积分别为C1、V1的NaOH溶液和C2、V2的CH3COOH溶液相混合,下列关于该混合溶液的叙述错误的是
A.若pH>7时,则一定是C1V1>C2V2
B.若pH<7时,混合溶液中可能有c(Na+)>c(H+)
C.当pH=7时,若V1=V2,则一定是C2 = C1
D.若V1=V2,C1=C2,则c(CH3COO-)+c(CH3COOH)=c(Na+)
难度: 困难查看答案及解析
-
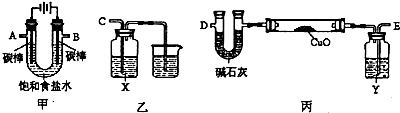
下列实验操作正确的是
A.用玻璃棒蘸取CH3COOH溶液,点在用水湿润的pH试纸上测定其pH
B.用25ml碱式滴定管量取20.00 mL KMnO4 溶液
C.为除去苯中的少量酚酞,向混合物中加入适量的氢氧化钠后分液
D.用右图装置加热分解NaHCO3

难度: 中等查看答案及解析