-
氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要应用.请回答下列问题。
(1)氮、磷、砷的电负性的大小关系是 ,砷原子M层电子排布式为 。
(2)K3[Fe(CN)6]晶体中Fe3+与CN-之间的键型为 ,该化学键能够形成的原因是 。
(3)已知:
| CH4 | SiH4 | NH3 | PH3 |
| 沸点(K) | 101.7 | 161.2 | 239.7 | 185.4 |
| 分解温度(K) | 873 | 773 | 1073 | 713.2 |
分析上表中四种物质的相关数据,请回答:
① CH4和SiH4比较,沸点高低的原因是 。
② NH3和PH3比较,分解温度高低的原因是 。
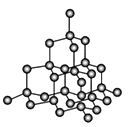
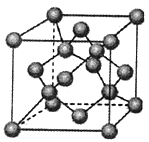
(4)金刚石是原子晶体,含有的最小环是六元环(如右边图),每个碳原子连接 个六元环,如左边图是金刚石的晶胞,若碳原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,碳原子在晶胞中的空间占有率 (不要求计算过程)。
-
[化学一选修3:物质结构与性质](15分)
氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要应用。回答下列问题:
(1)基态砷原子的电子排布式为 。
(2)K3[Fe(CN)6]晶体中Fe3+与CN一之间化学键类型为 键,与CN一互为等电子体的化合物分子式为 。
(3)PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾污染,光化学烟雾中含有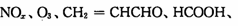
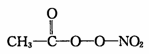 (PAN)等二次污染物。
(PAN)等二次污染物。
N2O结构式可表示为N=N=O,N2O中中心氮原子的杂化轨道类型为 ,1 mol PAN中含σ键数目为 。
测定大气中PM2.5的浓度方法之一是 一射线吸收法,
一射线吸收法, 一射线放射源可用85 Kr。Kr晶体为面心立方晶体,若晶体中与每个Kr原子相紧邻的Kr原子有m个,晶胞中含Kr原子为n个,则
一射线放射源可用85 Kr。Kr晶体为面心立方晶体,若晶体中与每个Kr原子相紧邻的Kr原子有m个,晶胞中含Kr原子为n个,则 = (填数字)。已知Kr晶体的密度为
= (填数字)。已知Kr晶体的密度为 g/cm3 ,摩尔质量为Mg/ mol,阿伏伽德罗常数用NA表示,列式表示Kr晶胞参数a= nm
g/cm3 ,摩尔质量为Mg/ mol,阿伏伽德罗常数用NA表示,列式表示Kr晶胞参数a= nm
-
[化学——物质结构与性质
氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要应用。回答下列问题:
(1)基态砷原子的电子排布式为 ;
(2)K3[Fe(CN)6]晶体中Fe3+与CN之间化学键类型为_________键,与CN互为等电子体的化合物分子式为 ;
(3)PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾污染,光化学烟雾中含有0
NOx、O3、CH2=CHCHO、HCOOH、CH3—C—0—0—N02 (PAN)等二次污染物。
①N2O结构式可表示为N = N = O,N2O中中心氮原子的杂化轨道类型为 ;
1 mol PAN含σ键数目为 ;
②测定大气中PM2.5的浓度方法之一是 -射线吸收法,
-射线吸收法, -射线放射源可用85Kr。K晶体为面心立方晶体,若晶体中与每个Kr原子相紧邻的Kr原子有m个,晶胞中含Kr原子为n个,则
-射线放射源可用85Kr。K晶体为面心立方晶体,若晶体中与每个Kr原子相紧邻的Kr原子有m个,晶胞中含Kr原子为n个,则 = (填数字)。已知Kr晶体的密度为pg/cm3,摩尔质量为Mg/mol,阿伏伽德罗常数用Na表示,列式表示Kr晶胞参数a= nm。
= (填数字)。已知Kr晶体的密度为pg/cm3,摩尔质量为Mg/mol,阿伏伽德罗常数用Na表示,列式表示Kr晶胞参数a= nm。
-
氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要应用.请回答下列问题.
(1)砷原子核外电子排布式为______.
(2)K3[Fe(CN)6]晶体中Fe3-与CN-之间的键型为______,该化学键能够形成的原因是______.
(3)NH4+中氮原子的杂化类型为______,NH4+的空间构型为______.
(4)已知:
| CH4 | SiH4 | NH3 | PH3 |
| 沸点(K) | 101.7 | 161.2 | 239.7 | 185.4 |
| 分解温度(K) | 873 | 773 | 1073 | 713.2 |
分析上表中四种物质的相关数据,请回答:
①CH4和SiH4比较,NH3和PH3比较,沸点高低的原因是______;
②CH4和SiH4比较,NH3和PH3比较,分解温度高低的原因是______;
结合上述数据和规律判断,一定压强下HF和HC1的混合气体降温时______先液化.
(5)电负性(用X表示)也是元素的一种重要性质,下表给出8种元素的电负性数值:
| 元素 | Na | Mg | Al | Si | P | S | Cl | K |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.8 | 2.1 | 2.5 | 3.0 | 0.8 |
请回答下列有关问题:
①估计钙元素的电负性的取值范围:______<X<______.
②经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键.试推断AIC13中形成的化学键的类型及其理由是______.
-
【化学—物质结构与性质】
氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要作用。
请回答下列问题。
(1)砷原子外围电子排布式为________。
(2)熔沸点:NH3________PH3(>、<、=)原因是________
(3)N、P、As三种元素电负性由小到大的顺序为________,NCl3分子中中心原子的杂化方式为。
(4)汽车尾气中CO和NO经催化剂作用变成N2和CO2,此反应中三种元素第一电离能由小到大的顺序为________,在这四种物质中含有极性键的非极分子内 键和
键和 键的比为________。
键的比为________。
(5)K3[Fe(CN)6]配合物中微粒的相互作用力有________,配位体为________。
A.氢键 B.离子键 C.共价键 D.配位键[ E.范德华力
(6)CO、NH3都能提供孤电子对与Cu+形成配合物。Cu+与NH3形成的配合物可表示为
[Cu(NH3)n]+。该配合物中,Cu+的4s轨道及4p轨道通过sp杂化接受NH3提供的孤电子对,则[Cu(NH3)n]+中n的值为________。
-
氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要应用.
(1)基态砷原子的电子排布式为 .
(2)K3[Fe(CN)5]晶体中Fe3+与CN﹣之间的化学键类型为 键,与CN﹣互为等电子体的化合物的分子式为 .
(3)氮化硼(BN)有多种晶型,其中立方氮化硼与金刚石的构型类似,则其晶胞中B﹣N﹣B之间的夹角是 (填角度).
(4)对硝基苯酚水合物(化学式为C4H5NO3•1.5H2O)是一种含氮化合物.实验表明:加热至94℃时该晶体会失去结晶水,由黄色变成鲜亮的红色,在空气中温度降低又变为黄色,具有可逆热色性.
①该晶体中四种基本元素的电负性由大到小的顺序是 .
②对硝基苯酚分子中氮原子的杂化轨道类型是 .
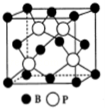
(5)磷化硼(BP)是一种有价值的耐磨硬涂层材料,这种陶瓷材料可作为金属表面的保护薄膜,它是通过在高温(T>750℃)氢气氛围下三溴化硼和三溴化磷反应制得的,三溴化硼分子的空间构型为 ,BP晶胞的结构如图所示,当晶胞晶格参数为478pm(即图中立方体的每条边长为478pm)时,磷化硼中硼原子和磷原子之间的最近距离为 .
-
C、Si、Ge、Sn是同族元素,该族元素单质及其化合物在材料、医药等方面有重要应用.请回答下列问题:
(1)32号元素Ge的原子核外电子排布式为 ________________________________________________________________________ ;
(2)C、Si、Sn三种元素的单质中,能够形成金属晶体的是________________________________________________________________ ;
(3)已知SnO2是离子晶体,写出其主要物理性质 ________________________________________________________ ;(写出2条即可)
(4)已知:
| CH4 | SiH4 | NH3 | PH3 |
| 沸点(K) | 101.7 | 161.2 | 239.7 | 185.4 |
| 分解温度(K) | 873 | 773 | 1073 | 713.2 |
分析上表中四种物质的相关数据,请回答:
①CH4和SiH4比较,NH3和PH3比较,沸点高低的原因是 ________________________________________________________________________________________;
②CH4和SiH4比较,NH3和PH3比较,分解温度高低的原因是 ________________________________________________________;
结合上述数据和规律判断,一定压强下HF和HCl的混合气体降温时 ________________________________________;
(5))用价层电子对互斥理论推断SnBr2分子中Sn—Br的键角 120°(填“>”“<”或“=”)。
(6)铅、钡、氧形成的某化合物的晶胞结构是:Pb4+处于立方晶胞顶点,Ba2+处于晶胞中心,O2-处于晶胞棱边中心,该化合物化学式为 ,每个Ba2+与 个O2-配位。
-
已知C、Si、Ge、Sn是同族元素,该族元素单质及其化合物在材料、医药等方面有重要应用。请根据题目要求回答下列问题:
(1)Ge的原子核外电子排布式为______________________________。
(2)C、Si、Sn三种元素的单质中,能够形成金属晶体的是___________。
(3)按要求指出下列氧化物的空间构型、成键方式或性质:
①CO2分子的空间构型及碳氧之间的成键方式_________________________________;
②SiO2晶体的空间构型及硅氧之间的成键方式_________________________________;
③已知SnO2是离子晶体,写出其主要物理性质(写出2条即可)___________________、____________________________________________________________。
(4)CO可以和很多金属形成配合物,如Ni(CO)2, 则Ni与CO之间的键型为__________。
(5)碳氧键的红外伸缩振动频率与键的强度成正比,已知Ni(CO)4中碳氧键的伸缩振动频率为2060cm3,CO分子中碳氧键的伸缩振动频率为2143cm2,则Ni(CO)4中碳氧键的强度比CO分子中碳氧键的强度__________(填字母)。
A.强 B.弱 C.相等 D.无法判断
-
铁、碳等元素的单质及其化合物在化工医药、材料等领域有着广泛的应用.回答下列问题:
(1) 的名称是三硝酸六尿素合铁
的名称是三硝酸六尿素合铁 Ⅲ
Ⅲ ,是一种重要的配合物.该化合物中
,是一种重要的配合物.该化合物中 的核外电子排布式为____,所含非金属元素的电负性由大到小的顺序为___
的核外电子排布式为____,所含非金属元素的电负性由大到小的顺序为___ 碳原子为____杂化,
碳原子为____杂化, 的空间构型为_____.
的空间构型为_____.
(2)尿素分子中 键
键 键的数目之比_____.
键的数目之比_____.
(3)目前发现的铝原子簇 的性质与卤素相似,则原子簇
的性质与卤素相似,则原子簇 属于____晶体.
属于____晶体. 存在的化学键有_____
存在的化学键有_____ 填字母
填字母 .
.
A.离子键  极性键
极性键  非极性键
非极性键  配位键
配位键  氢键
氢键  金属键
金属键
(4)已知: ,反应后,
,反应后, 键_____,
键_____, 键_____
键_____ 填“增加”或“减少”
填“增加”或“减少” .
.
(5)多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域 键”,如
键”,如 分子中存在“离域
分子中存在“离域 键”,可表示成
键”,可表示成 ,则
,则
 咪唑
咪唑 中的“离域
中的“离域 键”可表示为_________
键”可表示为_________
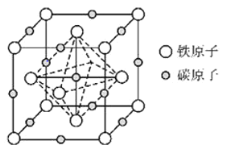
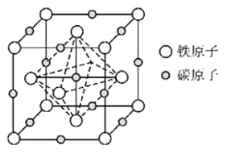
(6)奥氏体是碳溶解在 中形成的一种间隙固溶体,晶胞为面心立方结构,如图所示.若晶体密度为
中形成的一种间隙固溶体,晶胞为面心立方结构,如图所示.若晶体密度为 ,则晶胞中最近的两个碳原子之间的距离为______
,则晶胞中最近的两个碳原子之间的距离为______ 阿伏加德罗常数的值用
阿伏加德罗常数的值用 表示,写出简化后的计算式即可
表示,写出简化后的计算式即可 .
.
-
铁、碳等元素的单质及其化合物在化工医药、材料等领域有着广泛的应用.回答下列问题:
(1) 的名称是三硝酸六尿素合铁
的名称是三硝酸六尿素合铁 Ⅲ
Ⅲ ,是一种重要的配合物.该化合物中
,是一种重要的配合物.该化合物中 的核外电子排布式为____,所含非金属元素的电负性由大到小的顺序为___
的核外电子排布式为____,所含非金属元素的电负性由大到小的顺序为___ 碳原子为____杂化,
碳原子为____杂化, 的空间构型为_____.
的空间构型为_____.
(2)尿素分子中 键
键 键的数目之比_____.
键的数目之比_____.
(3)目前发现的铝原子簇 的性质与卤素相似,则原子簇
的性质与卤素相似,则原子簇 属于____晶体.
属于____晶体. 存在的化学键有_____
存在的化学键有_____ 填字母
填字母 .
.
A.离子键  极性键
极性键  非极性键
非极性键  配位键
配位键  氢键
氢键  金属键
金属键
(4)已知: ,反应后,
,反应后, 键_____,
键_____, 键_____
键_____ 填“增加”或“减少”
填“增加”或“减少” .
.
(5)多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域 键”,如
键”,如 分子中存在“离域
分子中存在“离域 键”,可表示成
键”,可表示成 ,则
,则
 咪唑
咪唑 中的“离域
中的“离域 键”可表示为_________
键”可表示为_________
(6)奥氏体是碳溶解在 中形成的一种间隙固溶体,晶胞为面心立方结构,如图所示.若晶体密度为
中形成的一种间隙固溶体,晶胞为面心立方结构,如图所示.若晶体密度为 ,则晶胞中最近的两个碳原子之间的距离为______
,则晶胞中最近的两个碳原子之间的距离为______ 阿伏加德罗常数的值用
阿伏加德罗常数的值用 表示,写出简化后的计算式即可
表示,写出简化后的计算式即可 .
.


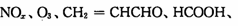
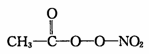 (PAN)等二次污染物。
(PAN)等二次污染物。
 ,反应后,
,反应后,
 ,反应后,
,反应后,