-
【化学—物质结构与性质】
氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要作用。
请回答下列问题。
(1)砷原子外围电子排布式为________。
(2)熔沸点:NH3________PH3(>、<、=)原因是________
(3)N、P、As三种元素电负性由小到大的顺序为________,NCl3分子中中心原子的杂化方式为。
(4)汽车尾气中CO和NO经催化剂作用变成N2和CO2,此反应中三种元素第一电离能由小到大的顺序为________,在这四种物质中含有极性键的非极分子内 键和
键和 键的比为________。
键的比为________。
(5)K3[Fe(CN)6]配合物中微粒的相互作用力有________,配位体为________。
A.氢键 B.离子键 C.共价键 D.配位键[ E.范德华力
(6)CO、NH3都能提供孤电子对与Cu+形成配合物。Cu+与NH3形成的配合物可表示为
[Cu(NH3)n]+。该配合物中,Cu+的4s轨道及4p轨道通过sp杂化接受NH3提供的孤电子对,则[Cu(NH3)n]+中n的值为________。
-
[化学一选修3:物质结构与性质](15分)
氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要应用。回答下列问题:
(1)基态砷原子的电子排布式为 。
(2)K3[Fe(CN)6]晶体中Fe3+与CN一之间化学键类型为 键,与CN一互为等电子体的化合物分子式为 。
(3)PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾污染,光化学烟雾中含有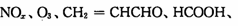
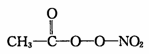 (PAN)等二次污染物。
(PAN)等二次污染物。
N2O结构式可表示为N=N=O,N2O中中心氮原子的杂化轨道类型为 ,1 mol PAN中含σ键数目为 。
测定大气中PM2.5的浓度方法之一是 一射线吸收法,
一射线吸收法, 一射线放射源可用85 Kr。Kr晶体为面心立方晶体,若晶体中与每个Kr原子相紧邻的Kr原子有m个,晶胞中含Kr原子为n个,则
一射线放射源可用85 Kr。Kr晶体为面心立方晶体,若晶体中与每个Kr原子相紧邻的Kr原子有m个,晶胞中含Kr原子为n个,则 = (填数字)。已知Kr晶体的密度为
= (填数字)。已知Kr晶体的密度为 g/cm3 ,摩尔质量为Mg/ mol,阿伏伽德罗常数用NA表示,列式表示Kr晶胞参数a= nm
g/cm3 ,摩尔质量为Mg/ mol,阿伏伽德罗常数用NA表示,列式表示Kr晶胞参数a= nm
-
[化学——物质结构与性质
氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要应用。回答下列问题:
(1)基态砷原子的电子排布式为 ;
(2)K3[Fe(CN)6]晶体中Fe3+与CN之间化学键类型为_________键,与CN互为等电子体的化合物分子式为 ;
(3)PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾污染,光化学烟雾中含有0
NOx、O3、CH2=CHCHO、HCOOH、CH3—C—0—0—N02 (PAN)等二次污染物。
①N2O结构式可表示为N = N = O,N2O中中心氮原子的杂化轨道类型为 ;
1 mol PAN含σ键数目为 ;
②测定大气中PM2.5的浓度方法之一是 -射线吸收法,
-射线吸收法, -射线放射源可用85Kr。K晶体为面心立方晶体,若晶体中与每个Kr原子相紧邻的Kr原子有m个,晶胞中含Kr原子为n个,则
-射线放射源可用85Kr。K晶体为面心立方晶体,若晶体中与每个Kr原子相紧邻的Kr原子有m个,晶胞中含Kr原子为n个,则 = (填数字)。已知Kr晶体的密度为pg/cm3,摩尔质量为Mg/mol,阿伏伽德罗常数用Na表示,列式表示Kr晶胞参数a= nm。
= (填数字)。已知Kr晶体的密度为pg/cm3,摩尔质量为Mg/mol,阿伏伽德罗常数用Na表示,列式表示Kr晶胞参数a= nm。
-
氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要应用.请回答下列问题。
(1)氮、磷、砷的电负性的大小关系是 ,砷原子M层电子排布式为 。
(2)K3[Fe(CN)6]晶体中Fe3+与CN-之间的键型为 ,该化学键能够形成的原因是 。
(3)已知:
| CH4 | SiH4 | NH3 | PH3 |
| 沸点(K) | 101.7 | 161.2 | 239.7 | 185.4 |
| 分解温度(K) | 873 | 773 | 1073 | 713.2 |
分析上表中四种物质的相关数据,请回答:
① CH4和SiH4比较,沸点高低的原因是 。
② NH3和PH3比较,分解温度高低的原因是 。
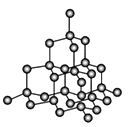
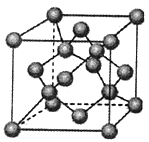
(4)金刚石是原子晶体,含有的最小环是六元环(如右边图),每个碳原子连接 个六元环,如左边图是金刚石的晶胞,若碳原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,碳原子在晶胞中的空间占有率 (不要求计算过程)。
-
氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要应用.请回答下列问题.
(1)砷原子核外电子排布式为______.
(2)K3[Fe(CN)6]晶体中Fe3-与CN-之间的键型为______,该化学键能够形成的原因是______.
(3)NH4+中氮原子的杂化类型为______,NH4+的空间构型为______.
(4)已知:
| CH4 | SiH4 | NH3 | PH3 |
| 沸点(K) | 101.7 | 161.2 | 239.7 | 185.4 |
| 分解温度(K) | 873 | 773 | 1073 | 713.2 |
分析上表中四种物质的相关数据,请回答:
①CH4和SiH4比较,NH3和PH3比较,沸点高低的原因是______;
②CH4和SiH4比较,NH3和PH3比较,分解温度高低的原因是______;
结合上述数据和规律判断,一定压强下HF和HC1的混合气体降温时______先液化.
(5)电负性(用X表示)也是元素的一种重要性质,下表给出8种元素的电负性数值:
| 元素 | Na | Mg | Al | Si | P | S | Cl | K |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.8 | 2.1 | 2.5 | 3.0 | 0.8 |
请回答下列有关问题:
①估计钙元素的电负性的取值范围:______<X<______.
②经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键.试推断AIC13中形成的化学键的类型及其理由是______.
-
氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要应用.
(1)基态砷原子的电子排布式为 .
(2)K3[Fe(CN)5]晶体中Fe3+与CN﹣之间的化学键类型为 键,与CN﹣互为等电子体的化合物的分子式为 .
(3)氮化硼(BN)有多种晶型,其中立方氮化硼与金刚石的构型类似,则其晶胞中B﹣N﹣B之间的夹角是 (填角度).
(4)对硝基苯酚水合物(化学式为C4H5NO3•1.5H2O)是一种含氮化合物.实验表明:加热至94℃时该晶体会失去结晶水,由黄色变成鲜亮的红色,在空气中温度降低又变为黄色,具有可逆热色性.
①该晶体中四种基本元素的电负性由大到小的顺序是 .
②对硝基苯酚分子中氮原子的杂化轨道类型是 .
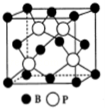
(5)磷化硼(BP)是一种有价值的耐磨硬涂层材料,这种陶瓷材料可作为金属表面的保护薄膜,它是通过在高温(T>750℃)氢气氛围下三溴化硼和三溴化磷反应制得的,三溴化硼分子的空间构型为 ,BP晶胞的结构如图所示,当晶胞晶格参数为478pm(即图中立方体的每条边长为478pm)时,磷化硼中硼原子和磷原子之间的最近距离为 .
-
【化学——选修3:物质结构与性质】(15分)
碳族元素C、Si、Ge的单质及其化合物在材料、医药等方面有重要的应用。请回答下列问题。
(1)Ge原子核外电子排布式为________________________。
(2)C元素的三种单质的晶体结构如图。
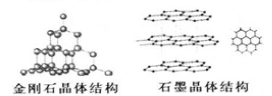
①金刚石晶体中碳原子与碳碳键的个数比为______;石墨晶体中碳原子的杂化类型为__________。
②石墨烯是从石墨材料中剥离出来的、由单层碳原子组成的二维晶体,每个碳原子提供一个p轨道上的电子形成大π键,π电子可以自由移动。将氢气加入到石墨烯中可制得一种新材料石墨烷。下列判断错误的是_______.
A.石墨烯是电的良导体而石墨烷则为绝缘体
B.石墨烯是一种强度很高的材料
C.石墨烯与石墨烷均为高分子化合物
D.石墨烯与H2制得石墨烷的反应属于加成反应
(3)碳元素的电负性比硅元素_______(填“大”或“小”)。CO2分子中碳氧原子之间化学键的成键方式为_________________。
(4)CO可以和很多金属形成配合物,如Ni(CO)4。
①其中Ni与CO之间的键型为_______。Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂,则固态Ni(CO)4属于________晶体。
②与配体CO互为等电子体的阴离子有________(任写一种)。NH3也可作为很多配合物的配体。其中N原子的杂化类型为_____________。若配离子[Ni(NH3)6]2-为正八面体结构,则[Ni(CO)2(NH3)4]2+的结构有____________种。
-
【化学-选修3:物质结构与性质】磷是人体含量较多的元素之一,磷的化合物在药物生产和农药制造等方面用途非常广泛。回答下列问题:
(1)基态磷原子核外共有________个未成对的电子。
(2)P4S3可用于制造火柴,其结构如图所示。
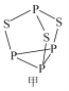
①电负性:磷_______硫;第一电离能:磷_______硫; (填“>”或“<)。
②P4S3中硫原子的杂化轨道类型为_______。
(3)N、P、As、Sb均是第VA族的元素。
①上述元素的氢化物的沸点关系如图乙所示,沸点:PH33,原因是_______;沸点:PH333,原因是_______。
②某种磁性氮化铁的晶胞结构如图丙所示,该化合物的化学式为_______。
(4)磷化铝熔点为2000℃,它与晶体硅互为等电子体,磷化铝晶胞结构如图丁所示。
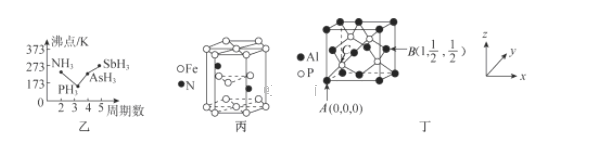
①图中A点和B点的原子坐标参数如图丁所示,则C点的原子坐标参数为_______。
②磷化铝晶体的密度为ρg·cm-3用NA表示阿伏加德罗常数的数值,则该晶胞中距离最近的两个铝原子之间的距离为_______cm。
-
元素周期表第ⅤA族元素包括氮、磷、砷(As)、锑(Sb)等。这些元素无论在研制新型材料,还是在制作传统化肥、农药等方面都发挥了重要的作用。请回答下列问题:
(1)N4分子是一种不稳定的多氮分子,这种物质分解后能产生无毒的氮气并释放出大量能量,能被应用于制造推进剂或炸药。N4是由四个氮原子组成的氮单质,其中氮原子采用的轨道杂化方式为sp3,该分子的空间构型为________,N—N键的键角为________。
(2)基态砷原子的最外层电子排布式为________。
(3)电负性是用来表示两个不同原子形成化学键时吸引键合电子能力的相对强弱,是元素的原子在分子中吸引共用电子对的能力。由此判断N、P、As、Sb的电负性从大到小的顺序是______________。
(4)联氨(N2H4)可以表示为H2N—NH2,其中氮原子采用的轨道杂化方式为________,联氨的碱性比氨的碱性________(填“强”或“弱”),其原因是________________________________________________________________。
写出N2H4与N2O4反应的化学方程式:____________________。
(5)元素X与N同周期,且X的原子半径是该周期主族元素原子半径中最小的,X与Ca形成的化合物CaX2的晶胞结构如图所示:
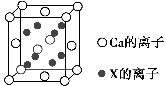
CaX2的晶体类型是________,一个晶胞中含有Ca的离子数为________,含有X的离子数为________。
-
元素周期表第ⅤA族元素包括氮、磷、砷(As)、锑(Sb)等。这些元素无论在研制新型材料,还是在制作传统化肥、农药等方面都发挥了重要的作用。请回答下列问题:
(1)N4分子是一种不稳定的多氮分子,这种物质分解后能产生无毒的氮气并释放出大量能量,能被应用于制造推进剂或炸药。N4是由四个氮原子组成的氮单质,其中氮原子采用的轨道杂化方式为sp3,该分子的空间构型为 ,N—N键的键角为 。
(2)基态砷原子的最外层电子排布式为 。
(3)电负性是用来表示两个不同原子形成化学键时吸引键合电子能力的相对强弱,是元素的原子在分子中吸引共用电子对的能力。由此判断N、P、As、Sb的电负性从大到小的顺序是 。
(4)联氨(N2H4)可以表示为H2N—NH2,其中氮原子采用的轨道杂化方式为 ,联氨的碱性比氨的碱性 (填“强”或“弱”),其原因是 。
写出N2H4与N2O4反应的化学方程式: 。
(5)元素X与N同周期,且X的原子半径是该周期主族元素原子半径中最小的,X与Ca形成的化合物CaX2的晶胞结构如图所示:
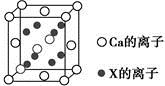
CaX2的晶体类型是 ,一个晶胞中含有Ca的离子数为 ,含有X的离子数为 。
键和
键的比为________。
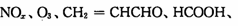
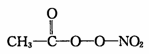 (PAN)等二次污染物。
(PAN)等二次污染物。






