-
下列化学方程式能用离子方程式2H++CO32-=H2O+CO2↑表示的是( )
A. HCl+NaHCO3=NaCl+H2O+CO2↑
B. 2HCl+BaCO3=BaCl2+H2O+CO2↑
C. H2SO4+Na2CO3=Na2SO4+H2O+CO2↑
D. 2CH3COOH+Na2CO3=2CH3COONa+H2O+CO2↑
难度: 简单查看答案及解析
-
下列各组晶体物质中,化学键类型相同,晶体类型也相同的是 ( )
①SiO2和SO3 ②晶体硼和HCl ③CO2和SO2 ④晶体硅和金刚石 ⑤晶体氖和晶体氮 ⑥硫黄和碘
A.①②③ B.④⑤⑥ C.③④⑥ D.①③⑤
难度: 中等查看答案及解析
-
某混合溶液中所含离子的浓度如下表,则 M 离子可能为 ( )
所含离子
NO3-
SO42-
H+
M
浓度/(mol∙L-1)
2
1
2
1
A.Cl- B.Ba2+ C.Na+ D.Mg2+
难度: 简单查看答案及解析
-
已知某元素的基态电子排布式为1s22s22p63s23p64s2,该元素在周期表中属于( )
A.ⅤB族 B.ⅡB族 C.Ⅷ族 D.ⅡA族
难度: 简单查看答案及解析
-
下表列出了某短周期元素R的各级电离能数据(用I表示,单位为kJ·mol-l)。下列关于元素R的判断中一定正确的是( )
电离能
I1
I2
I3
I4
……
E
740
1 500
7 700
10 500
……
A.R的最高正价为+3价
B.R元素的原子最外层共有4个电子
C.R元素位于元素周期表中ⅡA族
D.R 元素基态原子的电子排布式为1s22s2
难度: 简单查看答案及解析
-
如图表示的一些物质或概念之间的从属关系不正确的是( )
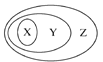
X
Y
Z
例
氧化物
化合物
纯净物
A
含氧酸
酸
化合物
B
溶液
分散系
混合物
C
强电解质
电解质
化合物
D
置换反应
氧化还原反应
离子反应
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
下列过程均有沉淀生成,其中属于化学变化的是( )
A.向蛋白质溶液中加入浓氯化铵溶液
B.两种不同品牌的墨水混合
C.向饱和BaSO4溶液中加入浓BaCl2溶液
D.向饱和Na2CO3溶液中通入CO2气体
难度: 简单查看答案及解析
-
下列过程对应的离子方程式正确的是
A.NaHSO3溶于水呈酸性:NaHSO3=Na++H++SO32-
B.在Na2S2O3溶液中滴加稀硫酸:2H++S2O32- = SO2↑+S↓+H2O
C.浓盐酸与MnO2反应制氯气:MnO2+4HCl=Mn2++2Cl2+2H2O
D.工业冶炼Mg:2Mg2++2O2-
2Mg+O2↑
难度: 中等查看答案及解析
-
在强酸性无色溶液中,下列离子组能大量共存的是( )
A.Na+、K+、OH-、Cl- B.Na+、Cu2+、SO
、NO
C.K+、Mg2+、SO
、Cl- D.Ba2+、HCO
、NO
、K+
难度: 中等查看答案及解析
-
下表中对应关系错误的是( )
A
NaCl=Na++Cl-;
NH3·H2O
NH
+OH-
均属于电离方程式
B
Ba2++SO
=BaSO4↓;
HCO
+OH-=CO
+H2O
均可表示一类反应
C
SO2使酸性高锰酸钾溶液褪色;
SO2使碱性酚酞溶液褪色
均利用SO2的同一性质
D
Cl2+2NaOH=NaCl+NaClO+H2O;
3S+6NaOH=2Na2S+Na2SO3+3H2O
Cl2和S在反应中既作氧化剂又作还原剂
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
下列说法中正确的是( )
A.1 mol S和O2的摩尔质量都是32 g
B.7.8 g Na2S与Na2O2的混合物约含有阴离子6.02×1022个
C.1 mol任何气体中都含有相同的原子数
D.22.4 L CO2气体中含有3NA个原子
难度: 简单查看答案及解析
-
下列基态原子的核外电子在原子轨道上的能量大小关系不正确的是
A.5s>4s B.4s >3d C.5d >4f D.5p>4d
难度: 简单查看答案及解析
-
联氨(N2H4)可作火箭的燃料,燃烧时反应为2N2H4+2NO2=3N2+4H2O,下列说法错误的是( )
A.此反应是氧化还原反应
B.反应瞬间产生大量高温气体,推动火箭飞行
C.N2H4的摩尔质量为32g/mol
D.此反应中N2H4作氧化剂
难度: 中等查看答案及解析
-
下列分子或离子中,立体构型是平面三角形的是( )
A.CH4 B.NH
C.NO
D.CO2
难度: 简单查看答案及解析
-
N2O既是医学上的一种麻醉剂,又是一种常见的温室气体。制取N2O的方法有很多,例如
①NH4NO3===N2O↑+2H2O
②K2SO3+2NO===K2SO4+N2O↑
③2NH3+2O2===N2O↑+3H2O
④2NaNO3+(NH4)2SO4===2N2O↑+Na2SO4+4H2O等。下列说法正确的是
A.反应①中硝酸铵既是氧化剂又是还原剂,H2O是氧化产物
B.反应②中K2SO3是还原剂,N2O是氧化产物
C.反应③中每生成1 mol N2O,转移8 mol电子
D.反应④中NaNO3是还原剂,N2O既是氧化产物又是还原产物
难度: 简单查看答案及解析
-
已知CsCl晶体的密度为ρg·cm-3,NA为阿伏加德罗常数的值,相邻的两个Cs+的核间距为acm,如图所示,则CsCl的相对分子质量可以表示为( )
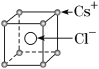
A.NA·a3·ρ B.
C.
D.
难度: 简单查看答案及解析
-
已知:①A+B2+=A2++B②D+2H2O=D(OH)2+H2↑③以B、E为电极与E的盐溶液组成原电池,电极反应为:E2++2e-=E,B-2e-=B2+,下列说法正确的是( )
A.氧化性:E2+>B2+>A2+>D2+ B.氧化性:D2+>E2+>A2+>B2+
C.反应E+A2+=A+E2+能够进行 D.提取某废水中含有少量的A2+时可以选用D
难度: 简单查看答案及解析
-
下列说法不正确的是( )
A.温度相同、体积相同的O2(g)和N2(g)所含的分子数一定相同
B.等温等压下,SO2气体与CO2气体的密度之比等于16∶11
C.温度和容积相同的两容器中分别盛有5molO2和2molN2,则压强之比为5∶2
D.等温等压条件下,5molO2(g)和2molH2(g)的体积之比等于5∶2
难度: 困难查看答案及解析
-
下列各组物质不互为等电子体的是( )
A.CO和N2 B.CO2和N2O
C.CO
和NO
D.CO2和SO2
难度: 简单查看答案及解析
-
下列说法或有关化学用语的表达正确的是( )
A.在基态多电子原子中,p轨道电子能量一定高于s轨道电子能量
B.基态Fe原子的外围电子排布图为
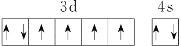
C.因氧元素电负性比氮元素大,故氧原子第一电离能比氮原子第一电离能大
D.根据原子核外电子排布的特点,Cu在元素周期表中位于s区
难度: 中等查看答案及解析