-
在100℃时,水的离子积等于1.0×10-12,若该温度下某溶液中的c(H+)=1×10-7 mol/L,则该溶液( )
A. 呈碱性 B. 呈酸性
C. 呈中性 D. c(H+)=c(OH-)
难度: 简单查看答案及解析
-
只改变一个影响化学平衡的因素,平衡常数K与化学平衡移动的关系叙述不正确的是( )
A.K不变,平衡可能移动
B.平衡向右移动时,K不一定变化
C.K有变化,平衡一定移动
D.相同条件下,同一个反应的方程式的化学计量数增大2倍,K也增大2倍
难度: 简单查看答案及解析
-
下列属于电解质的是( )
A.稀盐酸 B.蔗糖 C.硫酸铜 D.漂白粉
难度: 简单查看答案及解析
-
能证明乙酸是弱酸的实验事实是
A. CH3COOH溶液与Zn反应放出H2
B. 0.1 mol/L CH3COONa溶液的pH大于7
C. CH3COOH溶液与NaCO3反应生成CO2
D. 0.1 mol/L CH3COOH溶液可使紫色石蕊变红
难度: 中等查看答案及解析
-
常温下,1mol化学键分解成气态原子所需要的能量用E表示.结合表中信息判断下列说法不正确的是
共价键
436
157
568
432
298
A.432
B.表中最稳定的共价键是
键
C.H
D.H
难度: 中等查看答案及解析
-
下列反应在任何温度下均能自发进行的是
A. 2H2O2(l)= O2(g)+ 2H2O(l)△H= -196 kJ•mol-1
B. 2N2(g)+ O2(g)= 2N2O(g)△H=+163 kJ•mol-1
C. 2Ag(s)+ Cl2(g)= 2AgCl(s)△H=- 254 kJ•mol-1
D. 2HgO(s)= 2Hg(l)+ O2(g)△H= +182kJ•mol-1
难度: 简单查看答案及解析
-
一定温度下,在3个容积均为
的恒容密闭容器中反应
达到平衡,下列说法正确的是
容器
温度
物质的起始浓度
物质的平衡浓度
Ⅰ
400
0
Ⅱ
400
0
Ⅲ
500
0
A. 该反应的正反应是吸热反应
B. 达到平衡时,容器Ⅰ中反应物转化率比容器Ⅱ中的小
C. 达到平衡时,容器Ⅱ中
小于容器Ⅲ中
D. 达到平衡时,容器Ⅲ中的正反应速率比容器Ⅰ中的小
难度: 中等查看答案及解析
-
在四个不同容器中,不同条件下进行反应N2+3H2⇌2NH3,根据在相同时间内测定的结果,判断该反应的速率最大的是( )
A. υ(NH3)=0.5mol•L﹣1•min﹣1
B. υ(H2)=0.3mol•L﹣1•min﹣1
C. υ(N2)=0.2mol•L﹣1•min﹣1
D. υ(H2)=0.01mol•L﹣1•s﹣1
难度: 中等查看答案及解析
-
下列有关化学反应速率的说法正确的是( )
A.用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以加快产生氢气的速率
B.10.0 mL 2 mol·L ﹣1的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变
C.SO2的催化氧化是一个放热的反应,所以升高温度,反应速率减慢
D.汽车尾气中的NO和CO可以缓慢反应生成N2和CO2,减小压强,反应速率减慢
难度: 简单查看答案及解析
-
下列有关热化学方程式的表示及说法正确的是
A. 已知
,则氢气的燃烧热为-241.8kJ/mol
B.
、101 kPa时,求算固态碳和硫的燃烧热时.其分别燃烧时生成稳定的
和
C. 含
的稀溶液与稀硫酸完全中和,放出
的热量,则表示该反应的中和热的热化学方程式为:2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l)
D. 已知
,
,则
难度: 中等查看答案及解析
-
可逆反应:
在恒温恒容密闭容器中反应,达到平衡状态的标志是
单位时间内生成n
的同时消耗2n
;
单位时间内生成n
的同时消耗2n mol NO;
混合气体的颜色不再改变的状态;
混合气体中
不变;
的消耗速率与NO的生成速率相等;
容器内压强不随时间变化而变化。
A.
B.
C.
D.
难度: 中等查看答案及解析
-
已知:H2(g)+F2(g)=2HF(g) ΔH=-270 kJ·mol-1,下列说法正确的是:
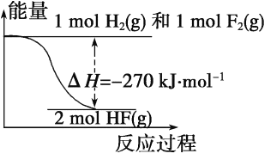
A. 氟化氢气体分解生成氢气和氟气的反应是放热反应
B. 1 mol H2与1 mol F2反应生成2 mol液态HF放出的热量小于270 kJ
C. 在相同条件下,1 mol H2与1 mol F2的能量总和小于2 mol HF气体的能量
D. 该反应中的能量变化可用如图来表示
难度: 中等查看答案及解析
-
下列说法正确的是
A. H2(g)+I2(g)
2HI(g),其他条件不变,缩小反应容器体积,正逆反应速率不变
B. 若压强不再随时间变化能说明反应A(?)+B(g)
2C(?)已达平衡,则A、C不能同时是气体
C. C(s)+H2O(g)
H2(g)+CO,碳的质量不再改变不能说明反应已达平衡
D. 2NO2
N2O4(无色),体系颜色不再变化说明反应已达平衡,反应停止
难度: 中等查看答案及解析
-
向绝热恒容密闭容器中通入
和
,一定条件下使反应
达到平衡,正反应速率随时间变化的示意图如图所示
由图得出的结论不正确的是
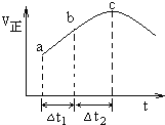
A. 反应过程中压强始终不变
B. 反应物浓度:a点大于b点
C. 反应物的总能量高于生成物的总能量
D.
时,
的转化率:
段小于
段
难度: 中等查看答案及解析
-
100 mL 2 mol·L-1 H2SO4溶液与过量锌粉反应,一定温度下,为了减缓反应进行的速率,但又不影响生成H2的总量,可向反应物中加入适量( )
A. 硝酸钠溶液 B. NaCl固体 C. 硫酸铜溶液 D. 硫酸钾溶液
难度: 中等查看答案及解析
-
反应:C(s)+H2O(g)
CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是:
A. 增加H2O (g) 的量
B. 保持体积不变,充入氦气使体系压强增大
C. 将容器的体积缩小一半
D. 保持压强不变,充入氦气使容器容积变大
难度: 中等查看答案及解析
-
室温下,在pH=12的强碱溶液中,由水电离出的c(OH-)为( )
A.1.0×10-7 mol•L-1 B.1.0×10-6 mol•L-1
C.1.0×10-2 mol•L-1 D.1.0×10-12 mol•L-1
难度: 简单查看答案及解析
-
某温度下,在一个1L的密闭容器中,加入2molA和1molB进行如下反应:2A(g)+2B(g)
3C(? )+D(? )。反应一段时间后达到平衡,测得生成0.6molC,且反应前后压强之比为15∶11(相同温度下测量),则下列说法正确的是( )
A. 该反应的化学平衡常数K约为0.043
B. 增加C的物质的量,B的平衡转化率不变
C. 增大该体系的压强,平衡正向移动,化学平衡常数增大
D. A的平衡转化率是40%
难度: 困难查看答案及解析
-
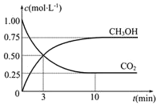
一定温度下在容积为2 L的密闭容器内进行某一反应,容器内气体X、气体Y的物质的量随反应时间变化的曲线如图所示。据图可知
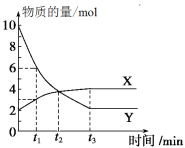
A.反应的化学方程式为4Y=X
B.反应进行到t1时,Y的浓度减少了3 mol·L-1
C.反应进行到t2时,达到平衡状态
D.反应进行到t3时,每生成4 mol Y的同时生成1 mol X
难度: 中等查看答案及解析
-
下列关于平衡体系的各说法中不正确的是( )
A.在N2+3H2
2NH3的平衡体系中,缩小体积,平衡向右移动,氨的产率增加
B.在CH3COOH
CH3COO-+H+的平衡体系中加入CH3COONa固体,平衡向左移动
C.纯水升温到100℃时,pH小于7,呈酸性
D.在盐酸中加入KCl晶体,溶液pH不变
难度: 简单查看答案及解析
-
pH=2的两种一元酸x和y,体积均为100 mL,稀释过程中pH与溶液体积的关系如下图所示。分别滴加NaOH溶液(c=0.1 mol·L-1)至pH=7。消耗NaOH溶液的体积为Vx、Vy则( )
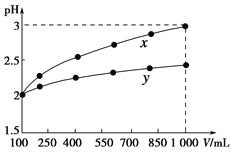
A.x为弱酸,Vx<Vy B.x为强酸,Vx>Vy
C.y为弱酸,Vx<Vy D.y为强酸,Vx>Vy
难度: 中等查看答案及解析
-
在CH3COOH溶液中存在如下平衡:CH3COOH⇌H++CH3COO-。加入少量下列物质或采取下述方法,能使平衡逆向移动的是
A.加水 B.CH3COONa固体 C.升温 D.NaCl固体
难度: 简单查看答案及解析
-
25℃时,水的电离达到平衡:H2O
H++OH﹣△H>0,下列叙述正确的是( )
A.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
B.向水中加入氨水,平衡逆向移动,c(OH﹣)降低
C.向水中加入金属钠,平衡正向移动,c(H+)增大
D.将水加热,KW增大,pH不变
难度: 中等查看答案及解析
-
下列四种溶液中,室温下由水电离生成的H+浓度之比(①:②:③:④)是( )
①pH=0的盐酸 ②0.1mol•L﹣1的盐酸 ③0.01mol•L﹣1的NaOH溶液④pH=11的NaOH溶液.
A.1:10:100:1 000 B.0:1:12:11
C.14:13:12:11 D.14:13:2:3
难度: 中等查看答案及解析
-
有等体积、等pH的Ba(OH)2、NaOH和NH3·H2O三种碱溶液,滴加等浓度的盐酸将它们恰好中和,用去酸的体积分别为V1、V2、V3,则三者的大小关系正确的是
A.V3>V2>V1 B.V3=V2=V1 C.V1=V2>V3 D.V3>V2=V1
难度: 简单查看答案及解析
-
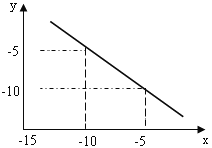
(原创)如图表示不同温度下水溶液中c(H+)与c(OH-)的关系,下列判断正确的是( )
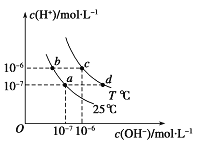
A.两条曲线上任意点均有c (H+) ×c (OH-)=Kw
B.T<25℃
C.b点和c点pH均为6,溶液呈酸性
D.只采用升温的方式,可由a点变成d点
难度: 中等查看答案及解析
-
已知下面三个数据:①7.2×10-4、②2.6×10-4、③4.9×10-10分别是三种酸的电离平衡常数,若已知这三种酸可发生如下反应:NaCN+HNO2=HCN+NaNO2,NaCN+HF=HCN+NaF,NaNO2+HF==HNO2+NaF,由此可判断下列叙述中正确的是( )
A.HF的电离常数是① B.HNO2的电离常数是①
C.HCN的电离常数是② D.HNO2的电离常数是③
难度: 中等查看答案及解析
-
在相同温度时,100mL0.01mol•L﹣1的醋酸溶液与10mL 0.1mol•L﹣1的醋酸溶液相比较,下列数值中,前者大于后者的是( )
A.H+的物质的量 B.醋酸的电离常数
C.中和时所需NaOH的量 D.CH3COOH的物质的量
难度: 中等查看答案及解析
-
如图是可逆反应A+2B
2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况。由此可推断( )
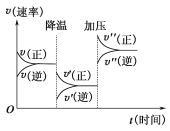
A.温度越高,该反应的化学平衡常数越大 B.若A、B是气体,则D是液体或固体
C.逆反应是放热反应 D.A、B、C、D均为气体
难度: 中等查看答案及解析
-
可逆反应aA(g)+bB(g)⇌ cC(g)+dD(g)△H同时符合下列两图中各曲线的是
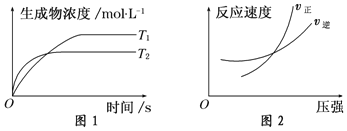
A.a+b>c+d T1>T2 △H>0 B.a+b>c+d T1<T2 △H<0
C.a+b<c+d T1>T2 △H>0 D.a+b<c+d T1<T2 △H<0
难度: 简单查看答案及解析