-
“笔、墨、纸、砚”在中国传统文化中被称为“文房四宝”,下列说法中错误的是( )
A.羊毫笔笔头用山羊毛制成,用灼烧法可鉴别羊毫和化纤
B.“松烟墨”以松树烧取的烟灰制成,用此墨写字日久会褪色
C.制作宣纸的原料有青檀树皮和稻草,其主要成分均是纤维素
D.端砚石主要成分含水白云母
,它属于硅酸盐
难度: 简单查看答案及解析
“笔、墨、纸、砚”在中国传统文化中被称为“文房四宝”,下列说法中错误的是( )
A.羊毫笔笔头用山羊毛制成,用灼烧法可鉴别羊毫和化纤
B.“松烟墨”以松树烧取的烟灰制成,用此墨写字日久会褪色
C.制作宣纸的原料有青檀树皮和稻草,其主要成分均是纤维素
D.端砚石主要成分含水白云母,它属于硅酸盐
难度: 简单查看答案及解析
下列有关实验的选项正确的是( )
| A.配制 | B.记录滴定终点读数为 | C.验证 | D.除去 |
|
|
|
|
|
A.A B.B C.C D.D
难度: 简单查看答案及解析
设为阿伏伽德罗常数的值。关于常温下
的
溶液,下列说法正确的是( )
A.溶液中
的数目为
B.加水稀释,水解常数增大,
减小
C.
D.加入固体,则水解平衡向左移动,
增大
难度: 中等查看答案及解析
2019年1月,嫦娥四号成功在月球着陆,探测器上的五星红旗由一类特殊的聚酰亚胺制成。某种芳香族聚酰亚胺(
 )由化合物
)由化合物(
)和另外一种物质合成,下列说法正确的是( )
A.与甲苯互为同系物 B.
分子中最多有12个原子共平面
C.的分子式为
D.
可发生加聚反应生成
难度: 中等查看答案及解析
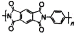
图1表示K、Cu、Si、H、C、N六种元素单质的熔点高低,其中c、d均是热和电的良导体,e常作为半导体材料。下列说法错误的是( )
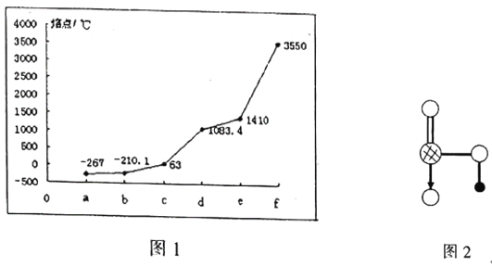
A.d的硫酸盐溶液呈酸性
B.a元素与b元素可形成核外电子总数为8的分子
C.图2为上述六种元素中的一种元素形成的含氧酸的结构
D.e单质能与c的最高价氧化物对应水化物的溶液发生反应
难度: 简单查看答案及解析
微生物电化学系统有两个研究方向。一是利用阳极室微生物降解有机废水,二是利用阴极还原能力处理含重金属废水。某文献报道,利用下图所示装置可使微生物和六价铬离子(Cr2O72—)不直接接触,处理高浓度含铬废水。装置工作时,下列说法错误的是( )
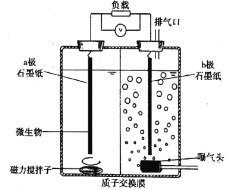
A.极附近
增大
B.该装置利用微生物产生电子和
C.极石墨纸发生反应:
D.利用该装置原理既能处理含铬废水,又能同步回收电能
难度: 中等查看答案及解析
已知:还原性,氧化性
,在含
的溶液中逐滴加入
溶液,加入
的物质的量和产生
的物质的量的关系曲线如图所示,下列叙述中正确的是( )
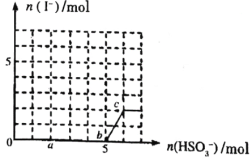
A.反应过程中溶液的先变小后变大
B.点时消耗的
的物质的量为
C.间反应:
D.溶液中与
的物质的量之比为
时,加入的
的物质的量为
难度: 中等查看答案及解析
铁及其化合物在生产生活中有广泛应用。
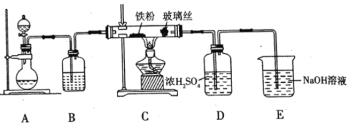
(1)可用作净水剂,也可用于无线电印刷电路做蚀刻剂。某化学兴趣小组利用如图所示装置向
的铁屑中通入
生产无水
。已知:
固体呈黑棕色、易潮解、
左右时升华。
回答下列问题
①写出用高锰酸钾和浓盐酸在装置中制备氯气的离子方程式_____。
②装置中加入的试剂是_____,装置
中玻璃丝的作用是_____,
中
溶液的作用是_____。
③有同学认为气体通入装置前应除去其中含有的
,改进措施为_____。
(2)一种新型高效净水剂(聚合氯化铁铝
,广泛用于日常生活用水和工业污水的处理。某化工厂欲以工业生产废料(金属铁、铝及其氧化物)为原料制取
,设计生产流程如下:
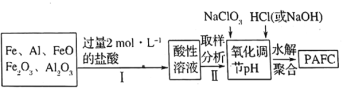
①实验室现需用的稀盐酸,欲用
的浓盐酸配制,则所需浓盐酸体积为________。
②中
显________价,
在强酸性和强碱性溶液中均________稳定存在(填“能”或“不能”)。
③步骤Ⅱ中取样分析的目的是________。
A.测定溶液中与
的含量比 B.测定原料是否完全溶解
C.测定溶液中的含量,以确定加入
的量 D.测定溶液中
的含量
难度: 中等查看答案及解析
工业上利用氟碳铈矿(主要成分)提取
的一种工艺流程如下:
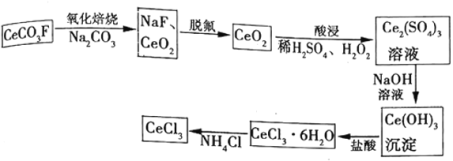
请回答下列问题:
(1)脱氟过程的实验操作是________,酸浸过程中加入的作用是________。
(2)常温下,若溶液中的沉淀完全,此时溶液的
为________(己知
)。
(3)准确称取样品置于锥形瓶中,加入适量过硫酸铵
溶液将
氧化为
,再用0.1000mol/L(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗30.00mL标准溶液。(己知:
)
①已知:过二硫化酸的结构式为,其中
元素的化合价为________。
②该样品中的质量分数为________(精确到
)。
③若使用久置的标准溶液进行滴定,测得该
样品的质量分数将________(填“偏大”“偏小”或“无影响”)。
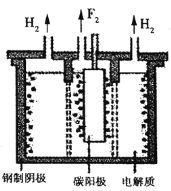
(4)脱氟过程中产生的因活性弱于熔融的氟氢化钾
,故现代工业以电解熔融的氟氢化钾和氟化氢
混合物制备氟单质,电原理为
装置如图所示。已知
是一种酸式盐,则阴极上发生的电极反应式为________。电解制氟时,要用镍铜合金隔板将两种气体产物严格分开的原因是________。
难度: 中等查看答案及解析
甲醇是一种新型的汽车动力燃料。回答下列问题:
⑴工业上可通过和
化合来制备甲醇。已知某些化学键的键能数据如下表:
| 化学键 | | | | | |
| 键能 | 413 | 436 | 358 | 1072 | 463 |
已知中的
与
之间为三键,则工业制备甲醇的热化学方程式为________。
⑵某化学研究性学习小组模拟工业合成甲醇的反应,在容积固定为的密闭容器内充入
和
,加入合适催化剂(体积可以忽略不计),在
时开始反应,并用压力计监测容器内压强的变化如下表:
| 反应时间/ | 0 | 5 | 10 | 15 | 20 | 25 |
| 压强/ | 10.8 | 9.6 | 8.4 | 7.8 | 7.2 | 7.2 |
则从反应开始到时,以
表示的平均反应速率
________,该温度下平衡常数
________
,若升高温度,则
值________(填“增大”“减小”或“不变")。
⑶模拟工业合成甲醇的反应,下图是4种投料比分别为
、
、
、
下,反应温度对
平衡转化率影响的曲线。
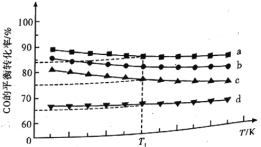
①曲线对应的投料比为________。
②当曲线、
、
对应的投料比达到相同的
平衡转化率时,对应的反应温度与投料比的关系是________。
③投料比为、反应温度为
时,平衡混合气中
的物质的量分数是________(精确到
)。
难度: 简单查看答案及解析
砷化镓为黑灰色固体,是重要的半导体材料,用砷化镓制成的半导体器件具有低温性能好、抗辐射能力强等优点。请回答下列问题:
(1)基态原子核外电子占据最高能级的电子云轮廓图为________形。
(2)砷化镓可由和
制得。在常温常压下,
为无色透明液体,则
固体属于________晶体。
的沸点低于
的原因为________。
(3)亚砷酸是一种三元弱酸,分子中含有羟基数目为________个;根据价层电子对互斥理论推测
的空间构型为________;与
互为等电子体的一种分子为________。
(4)的熔点为
,晶胞结构如图所示:
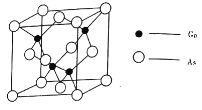
①在晶体中,镓原子的配位数是________,与同一个镓原子相连的砷原子构成的空间构型为________。
②若砷化镓晶胞边长为。则该晶体密度为________
(用含
的代数式表示)。
难度: 困难查看答案及解析
丹参素(I)是一种具有改善心脏功能、抗血栓形成、促进组织的修复与再生等多种作用的药物。该药物的一种合成路线如下:
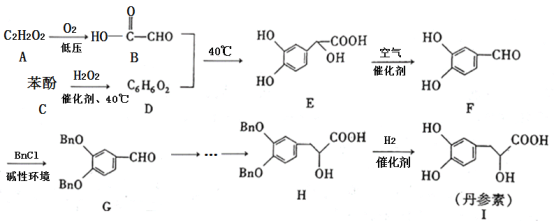
已知:代表苄基(
)
请回答下列问题:
(1)的结构简式为_______,
中所含官能团的名称为羟基、______。
(2)的反应类型为_______,该反应的目的是________。
(3)写出的化学方程式:________。
(4)苯酚与反应可以制备物质
(
)。
是
的同系物,相对分子质量比
大14。则符合下列条件的
的同分异构体有______种(不考虑立体异构)。
①苯环上只有两个取代基 ②能与溶液发生显色反应 ③能发生银镜反应 ④红外光谱表明分子中不含醚键
其中核磁共振氢谱有6组峰,且峰面积之比为的结构简式为________(写出一种即可)。
(5)参照丹参素的上述合成路线,以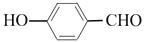 为原料,设计制备
为原料,设计制备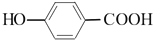 的合成路线:____________。
的合成路线:____________。
难度: 困难查看答案及解析