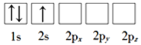
-
X、Y、Z、W是原子序数依次增大的四种短周期元素,其中只有一种是金属元素,X、W同主族且能形成一种离子化合物WX;Y的气态氢化物、最高价氧化物的水化物可反应生成一种盐;Z原子的最外层电子数与其电子总数之比为3∶4。下列说法中正确的是( )
A. 原子半径:W>Z>Y>X
B. 氢化物稳定性:Y>Z
C. WY3中只有离子键没有共价键
D. X与Z可形成10电子和18电子分子
难度: 中等查看答案及解析
-
价电子排布为5s25p1的元素,在周期表中的位置是
A.第四周期第ⅤA族 B.第五周期第ⅢA族
C.第五周期第ⅠA族 D.第四周期第ⅢA族
难度: 简单查看答案及解析
-
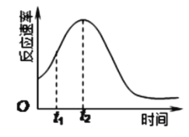
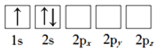
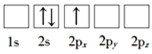
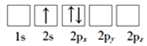
下列化学用语的表述不正确的是
A.过氧化氢的结构式:H—O—O—H
B.氮原子的L层电子轨道表示式:
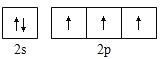
C.CO2的比例模型:
D.Cl-的结构示意图:
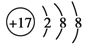
难度: 中等查看答案及解析
-
下列是同周期元素基态原子的最外层电子排布式,所表示的原子最容易得到电子的是
A.ns2 B.ns2np1 C.ns2np4 D.ns2np5
难度: 简单查看答案及解析
-
不同元素的原子在分子内吸引电子的能力大小可用一定数值X来表示,若X越大,则原子吸引电子的能力越强,在所形成的分子中成为负电荷一方。下面是某些短周期元素的X值:下列说法不正确的是( )
元素
Li
Be
B
C
O
F
X值
0.98
1.57
2.04
2.53
3.44
4.00
元素
Na
Al
Si
P
S
Cl
X值
0.93
1.61
1.90
2.19
2.58
3.16
A.通过分析X值变化规律0.93<X(Mg)<1.57
B.某化合物分子中含有S—N键,共用电子对偏向S
C.AlCl3为共价型化合物
D.预测元素周期表中,X值最小的元素位置为第六周期IA族(放射性元素除外)。
难度: 中等查看答案及解析
-
第四周期的元素基态原子中,4s能级只有1个电子的元素共有
A.1种 B.2种 C.3种 D.4种
难度: 简单查看答案及解析
-
下列分子中所有原子都满足最外层为8电子结构的是( )
A.BF3 B.H2O C.NO2 D.CO2
难度: 简单查看答案及解析
-
碳酸亚乙酯是锂离子电池低温电解液的重要添加剂,结构如图,下列说法正确的是( )
A.分子式为C3H6O3
B.分子中既有极性键也有非极性键
C.分子中σ键与π键个数之比为3:1
D.分子中碳原子的杂化方式全部为sp2杂化
难度: 中等查看答案及解析
-
某学生欲完成2HCl+2Ag═2AgCl+H2↑反应,设计了下列四个实验,你认为可行的实验是( )
A.
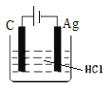 B.
B.
C.
 D.
D.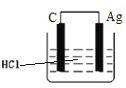
难度: 中等查看答案及解析
-
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示,下列说法正确的是
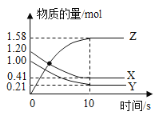
A.反应开始到10s,用Z表示的反应速率为
B.反应开始到10s,X的物质的量浓度减少了
C.反应开始到10s时,Y的转化率为
D.反应的化学方程式为:
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.40gNaOH中含有的共用电子对数为2NA
B.常温常压下,1.8g甲基(—CD3)中含有的中子数为0.9NA
C.31g白磷(
)含有共价键的总数为6NA
D.标况下,22.4LH2O中所含氢氧键的数目约为2NA
难度: 中等查看答案及解析
-
已知部分弱酸的电离平衡常数如表:
弱酸
醋酸
次氯酸
碳酸
亚硫酸
电离平衡常数(25℃)
Ka=1.75×10-5
Ka=2.98×10-8
Ka1=4.30×10-7
Ka2=5.61×10-11
Ka1=1.54×10-2
Ka2=1.02×10-7
下列离子方程式正确的是( )
A.少量CO2通入NaClO溶液中:CO2+H2O+2ClO-═CO
+2HClO
B.少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO
C.少量SO2通入Na2CO3溶液中:SO2+H2O+2CO
═SO
+2HCO
D.相同浓度NaHCO3溶液与醋酸溶液等体积混合:H++HCO
═CO2↑+H2O
难度: 中等查看答案及解析
-
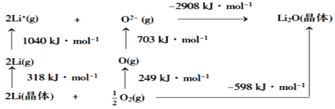
某科研小组公司开发了Li-SO2Cl2军用电池,其示意图如图所示,已知电池反应为:2Li+SO2Cl2=2LiCl+SO2↑。下列叙述中错误的是
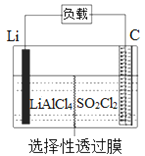
A. 电池工作时负极材料是Li,发生氧化反应
B. 将电解质溶液改为LiCl的水溶液,电池性能会更好
C. 电池工作时电子流向:锂电极→导线→负载→碳棒
D. 电池工作过程中,石墨电极反应式为SO2Cl2+2e−=2Cl−+SO2↑
难度: 困难查看答案及解析
-
已知通过乙醇制取氢气有如下两条路线:
a.CH3CH2OH(g)+H2O(g)⇌4H2(g)+2CO(g) △H=+255.6kJ•mol-1
b.CH3CH2OH(g)+
O2(g)⇌3H2(g)+2CO(g) △H=+13.8kJ•mol-1
则下列说法不正确的是( )
A.降低温度,可提高b路线中乙醇的转化率
B.从能量消耗的角度来看,b路线制氢更加有利
C.乙醇可通过淀粉等生物原料发酵制得,属于可再生资源
D.由a、b知:2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ•mol-1
难度: 中等查看答案及解析
-
常温下,用0.100mol•L-1NaOH溶液分别滴定20.00mL浓度均0.100mol•L-1CH3COOH溶液和HCN溶液,所得滴定曲线如图。下列说法不正确的是( )
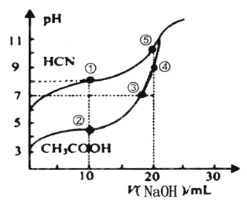
A.点①和点②所示溶液中:c(CH3COO-)>c(CN-)
B.点③时:c(Na+)=c(CH3COO-)>c(H+)=c(OH-)
C.点③和点④所示溶液中水的电离程度:③<④
D.点④溶液中阴离子总数小于点⑤
难度: 中等查看答案及解析
-
液氨和水类似,也能电离:NH3+NH3⇌NH
+NH
,25℃时其离子积K=l.0×l0-30。现将2.3g金属钠投入1.0L液氨中,钠完全反应,有NaNH2和H2产生,则所得溶液中不存在的关系式是( )(设温度保持不变,溶液体积为仍1L)
A.c(Na+)=c(NH
) B.c(NH
)=1×10-29mol/L
C.c(NH
)>c(NH
) D.c(NH
)∙c(NH
)=l.0×l0-30
难度: 中等查看答案及解析