-
“春蚕到死丝方尽,蜡炬成灰泪始干”是唐代诗人李商隐的著名诗句,下列关于该诗句中所涉及物质的说法错误的是
A. 蚕丝的主要成分是蛋白质
B. 蚕丝属于天然高分子材料
C. “蜡炬成灰”过程中发生了氧化反应
D. 古代的蜡是高级脂肪酸酯,属于高分子聚合物
难度: 简单查看答案及解析
-
下列说法中不正确的是
①糖类、油脂、蛋白质都是高分子化合物,适当条件下均可发生水解
②油脂、乙酸乙酯都是酯类,但不是同系物
③重油的裂化,煤的气化、液化、干馏等过程均为化学变化
④蛋白质的变性和盐析都不是可逆过程
⑤塑料、橡胶和纤维都是天然高分子材料
A.④ B.①②③④⑤ C.①④⑤ D.②③
难度: 简单查看答案及解析
-
以下实验:
①为检验RX是碘代烷,将RX与NaOH水溶液混合加热后,先加足量稀硝酸酸化,再加入AgNO3溶液,观察沉淀颜色;
②为验证淀粉在稀硫酸催化下水解产物,向溶液中直接加入银氨溶液并水浴加热,观察是否产生银镜;
③将苯和溴水混合,加入FeBr3,可制得溴苯
④在试管中加入2mL10%的CuSO4溶液,滴入2%的NaOH溶液4~6滴,振荡后加入乙醛溶液0.5mL,加热至沸腾来检验醛基
其中可能失败的实验是
A.①④ B.①②④ C.②③④ D.①③
难度: 中等查看答案及解析
-
在抗击“2019新型冠状病毒”的过程中,大量防护和消毒用品投入使用。下列有关说法正确的是
A.新型冠状病毒由C、H、O三种元素组成
B.过氧化氢、乙醇、过氧乙酸等消毒液均可以将病毒氧化而达到消毒目的
C.聚丙烯和聚四氟乙烯为生产防护服的主要材料,二者均属于有机高分子材料
D.84消毒液是以NaClO为主要有效成分的消毒液,与医用酒精混合可以提升消毒效果
难度: 简单查看答案及解析
-
下列表示物质的化学用语正确的是
A.硝基苯的结构简式
B.葡萄糖的实验式为CH2O
C.CO2分子的比例模型
 D.
D.键电子云模型
难度: 简单查看答案及解析
-
下列状态的氮中,能表示最低能量状态的轨道表示式是
A.
B.
C.
D.
难度: 中等查看答案及解析
-
下列有关电离能的说法正确的是
A.第一电离能是元素的原子失去核外第一个电子需要的能量
B.第一电离能越大的原子,失电子的能力越强
C.同周期元素的原子第一电离能从左到右越来越大
D.对于同一元素而言,可通过逐级电离能的数值,判断元素可能的化合价
难度: 中等查看答案及解析
-
下列叙述正确的是
A.
的空间构型为平面三角形 B.CS2为V型极性分子
C.H2O2是含有非极性键的非极性分子 D.
的中心原子是sp3杂化
难度: 简单查看答案及解析
-
向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液。下列对此现象说法正确的是
A.反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变
B.沉淀溶解后,生成深蓝色的配合离子
C.
比
中的配位键稳定
D.用硝酸铜溶液代替硫酸铜溶液进行实验,不能观察到同样的现象
难度: 简单查看答案及解析
-
下列叙述正确的是
A.杂化轨道只用于形成
键或用于容纳未参与成键的孤电子对
B.凡是中心原子采取
杂化轨道成键的分子,其几何构型都是正四面体形
C.CH2=CH2分子中共有四个σ键和一个π键
D.若把H2S分子写成H3S分子,违背了共价键的方向性
难度: 简单查看答案及解析
-
有机物X的结构简式如图,某同学对其可能具有的化学性质进行了预测,其中正确的是
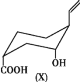
①可以使酸性KMnO4溶液褪色
②一定条件下能与H2发生加成反应
③可以和NaHCO3溶液反应
④在浓硫酸、加热条件下,能与冰醋酸发生酯化反应
A.①② B.②③ C.①②③ D.①②③④
难度: 简单查看答案及解析
-
关于键长、键能和键角的说法中不正确的是( )
A.键角是描述分子立体结构的重要参数
B.键长的大小与成键原子的半径和成键数目有关
C.键能越大,键长就越长,共价化合物也就越稳定
D.键角的大小与键长、键能的大小无关
难度: 中等查看答案及解析
-
下列方法(必要时可以加热),不能达到目的的是
A.用新制氢氧化铜悬浊液来鉴别葡萄糖、甲酸、乙酸、乙醇
B.皮肤上若沾有少量苯酚,可用冷水冲洗
C.用浓硝酸鉴别蚕丝和人造丝
D.用NaOH溶液鉴别植物油、汽油和甘油
难度: 简单查看答案及解析
-
下列说法正确的是
A.乙酸乙酯的碱性水解属于取代反应,又叫皂化反应
B.淀粉和纤维素分子式均可表示成(C6Hl0O5)n,它们互为同分异构体
C.变质的油脂有难闻的特殊气味,是由于油脂发生了水解反应
D.氨基酸和蛋白质分子中都含有氨基和羧基,二者均有两性
难度: 简单查看答案及解析
-
下列化合物中含有2个手性碳原子的是( )
A.
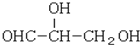 B.
B.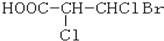
C.
D.
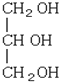
难度: 简单查看答案及解析
-
下列叙述正确的是
A.同周期非金属元素的氧化物对应水化物的酸性从左到右依次增强
B.无机含氧酸分子中含有几个氢原子,它就属于几元酸
C.同一元素的含氧酸,该元素的化合价越高,其酸性越强,氧化性也越强
D.H3PO4和H2CO3分子中非羟基氧的个数均为1,但它们的酸性不相近,H3PO4是中强酸而H2CO3是弱酸
难度: 中等查看答案及解析
-
下列各项叙述中,正确的是
A.价电子排布为4s24p3的元素位于第四周期第ⅤA族,是p区元素
B.N、P、As的电负性随原子序数的增大而增大
C.2p和3p轨道形状均为纺锤形,能量也相等
D.分子晶体中都存在共价键
难度: 简单查看答案及解析
-
下图为甲烷晶体的晶胞结构,下列有关说法正确的是( )
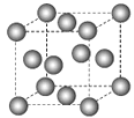
A.甲烷晶胞中的球体只代表一个碳原子
B.晶体中1个
分子有12个紧邻的甲烷分子
C.
晶体熔化时需克服共价键
D.一个甲烷晶胞中含有8个
分子
难度: 简单查看答案及解析
-
下列现象与氢键有关的有几项
①H2O的熔、沸点比VIA族其他非金属元素氢化物的高
②同碳数的多元醇比一元醇在水中溶解度大,小分子的醇、羧酸可以和水以任意比互溶
③冰的密度比液态水的密度小
④邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低
⑤水分子高温下也很稳定
A.5项 B.4项 C.3项 D.2项
难度: 中等查看答案及解析
-
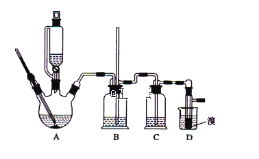
下列实验装置能达到实验目的的是( )(夹持仪器未画出)
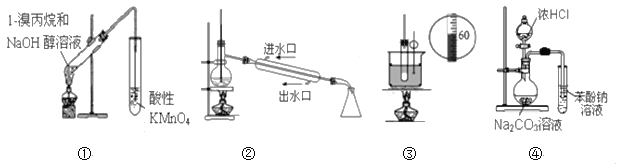
A. ①装置用于检验1-溴丙烷消去反应的产物
B. ②装置用于石油的分馏
C. ③装置用于实验室制硝基苯
D. ④装置可装置证明酸性:盐酸>碳酸>苯酚
难度: 中等查看答案及解析
-
已知信息:[Cu(NH3)4]SO4的电离方程式为[Cu(NH3)4]SO4=[Cu(NH3)4]2++SO42-。具有6个配体的Co3+的八面体配合物CoClm·nNH3,若1mol此配合物与足量的AgNO3溶液反应生成2molAgCl沉淀,则m、n分别是
A.m=3 n=5 B.m=3 n=3 C.m=3 n=4 D.m=5 n=1
难度: 中等查看答案及解析
-
下列离子方程式正确的是( )
A. 用银氨溶液检验乙醛中的醛基:CH3CHO+2Ag(NH3)2+ +2OH-
CH3COONH4 +3NH3+2Ag↓+H2O
B. 苯酚钠溶液中通入少量CO2:CO2 +H2O+2C6H5O-→2C6H5OH+CO32-
C. 乙酸滴入氢氧化铜悬浊液中:2CH3COOH+Cu(OH)2=Cu2++2CH3COO-+2H2O
D. 氯乙烷中滴入AgNO3溶液检验其中氯元素:Cl-+Ag+=AgCl↓
难度: 中等查看答案及解析
-
甲、乙、丙三种有机化合物的键线式如图所示。下列说法错误的是
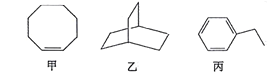
A.甲、乙的化学式均为C8H14
B.乙的二氯代物共有7种(不考虑立体异构)
C.丙的名称为乙苯,其分子中所有碳原子可能共平面
D.甲、乙、丙均能使酸性高锰酸钾溶液褪色
难度: 中等查看答案及解析
-
第ⅤA族元素的原子R与A原子结合形成RA3气态分子,其立体结构呈三角锥形。RCl5在气态和液态时,分子结构如图所示,下列关于RCl5分子的说法中正确的是( )
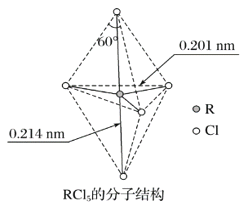
A.每个原子都达到8电子稳定结构
B.键角(Cl—R—Cl)有90°、120°、180°几种
C.RCl5受热后会分解生成分子RCl3,RCl5和RCl3都是极性分子
D.分子中5个R—Cl键键能各不相同
难度: 困难查看答案及解析
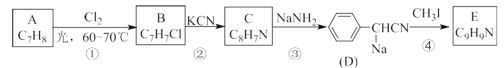
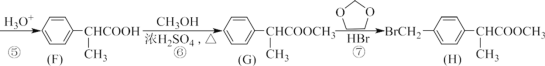
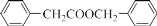 的合成路线____。
的合成路线____。 ,该同学所画的电子排布图违背了_____________。
,该同学所画的电子排布图违背了_____________。