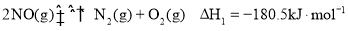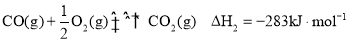-
中国是瓷器的故乡,有“瓷都”之称的江西景德镇出产的青花瓷是瓷器的代表,蓝紫色的硅酸铜钡(BaCuSi2O6)是瓷器加工中常用的颜料。下列说法正确的是
A.瓷器属于新型无机硅酸盐产品
B.硅酸铜钡还可表示为BaO·CuO·2SiO2
C.石灰石、黏土是生产瓷器的主要原料
D.瓷器具有较高的强度与硬度
难度: 简单查看答案及解析
-
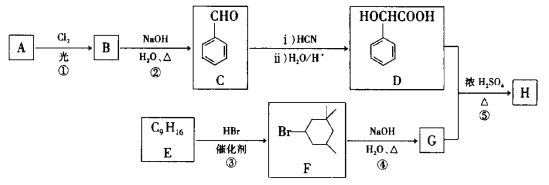
有机物X与Y反应可得到一种重要的有机物Z。下列说法错误的是
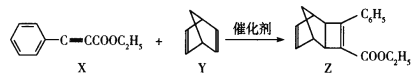
A.Z分子中共平面的碳原子最多有7个
B.X、Z均能与NaOH溶液反应
C.上述反应中,X、Y均发生了加成反应
D.Y与甲苯互为同分异构体
难度: 中等查看答案及解析
-
某无色溶液W由下列离子中的若干种组成:H+、
、Fe3+、Ba2+、Mg2+、
、I-、OH-、
。向W中加入铝粉后有气体Y、含铝元素的离子X等生成。若不考虑水的电离,则下列说法中正确的是
A.X一定是Al3+ B.Y一定是H2
C.W中最多含有6种离子 D.溶液中不可能含
难度: 困难查看答案及解析
-
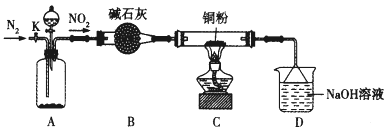
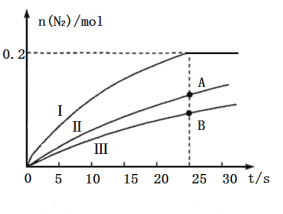
下列实验装置能达到相应实验目的的是
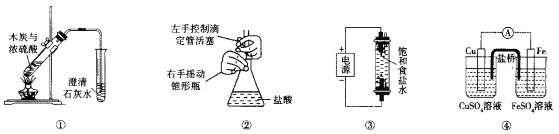
A.装置①用于验证反应是否有CO2生成
B.装置②用于用标准NaOH溶液测定盐酸浓度
C.装置③用于制备少量含NaClO的消毒液
D.装置④用于比较铜、铁活泼性强弱
难度: 简单查看答案及解析
-
用原电池原理可以除去酸性废水中的三氯乙烯和
,其原理如图所示(导电壳内部为纳米铁)。下列说法正确的是

A.纳米铁发生还原反应
B.正极电极反应式:C2HCl3+5H++8e-=C2H6+3Cl-
C.导电壳上电极反应式:
+
+14Fe2++14H+=FeAsS↓+13Fe3++7H2O
D.当电路中有0.4 mol电子转移时,就会有11.2 L乙烷生成
难度: 中等查看答案及解析
-
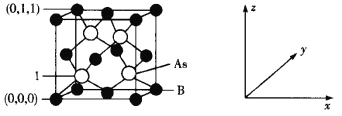
X、Y、Z、W是质子数依次增大的短周期主族元素,它们形成的某种化合物Q的结构式如图所示。X与W形成的化合物M常温下是液体。下列说法正确的是
A.X与Z可形成质子数、电子数均相同的ZX3、
B.M热稳定性强且具有弱氧化性
C.Q分子中各原子最外电子层均达到稳定结构
D.X、Y、Z、W四种元素间只能形成共价化合物
难度: 中等查看答案及解析
-
常温下,Ksp(CaCO3)=2.8×10-9,CaSO4在水中的沉淀溶解平衡曲线如图所示。下列判断错误的是
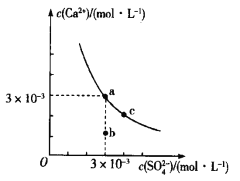
A.a点是CaSO4的饱和溶液而b点不是
B.蒸发水可使溶液由b点变化到a点
C.常温下,CaCO3(s)+
(aq)
CaSO4(s)+
(aq)的K=3.1×10-4
D.除去锅炉中的CaSO4时,可用Na2CO3溶液将其转化为CaCO3
难度: 中等查看答案及解析