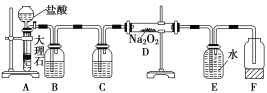
-
用FeCl3溶液腐蚀印刷电路板上的铜,所得溶液中加入过量的铁粉,充分反应后,最终溶液中的金属阳离子( )
A.只含Fe2+ B.含Cu2+和Fe2+ C.含Cu2+和Fe3+ D.只含Fe3+
难度: 简单查看答案及解析
-
已知:aA+、bB2+、cC-、dD2-具有相同的电子层结构,有关A、B、C、D四种元素的叙述中正确的是( )
A.原子序数:b>a>c>d
B.原子半径:A>B>C>D
C.金属性:B>A,非金属性:D>C
D.离子半径:D2->C->B2+>A+
难度: 简单查看答案及解析
-
短周期元素A、B、C 在元素周期表中所处的位置如图所示,A、B、C 三种元素原子的质子数之和为32,D 元素原子的最外层电子数为其次外层电子数的2倍。则下列说法正确的是
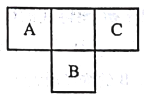
A. B的气态氢化物比C的气态氢化物稳定
B. 元素D形成的气态氢化物一定是正四面体形分子
C. A、B两种元素的气态氢化物均能与它们的最高价氧化物对应的水化物发生反应,且反应类型相同
D. 四种元素的原子半径:B>D>A>C
难度: 中等查看答案及解析
-
原子电子层数相同的X、Y、Z三种元素,若最高价氧化物的水化物酸性强弱为H3XO4<H2YO4<HZO4,则下列判断正确的是
A.非金属性强弱为X>Y>Z
B.原子半径为X<Y<Z
C.阴离子的还原性为X3->Y2->Z-
D.气态氢化物的稳定性为H3X>H2Y>HZ
难度: 中等查看答案及解析
-
下列物质只含有离子键的是
A.CO2 B.NaOH C.MgCl2 D.H2O
难度: 简单查看答案及解析
-
A、B是元素周期表中同周期的两种主族元素,它们可以形成离子化合物AmBn,且离子均达到稀有气体原子的电子层结构。若A的原子序数为a,则B的原子序数可能是
A.a+8+m-n B.a+18-m+n C.a+32-m-n D.a+24-m-n
难度: 中等查看答案及解析
-
离子化合物是离子通过离子键结合成的化合物.下列物质属于离子化合物的是
A.H2O B.HCl C.NaCl D.CO2
难度: 中等查看答案及解析
-
对于反应中的能量变化,表述正确的是( )
A.放热反应中,反应物的总能量大于生成物的总能量
B.断开化学键的过程会放出能量
C.加热才能发生的反应一定是吸热反应
D.氧化反应均为吸热反应
难度: 简单查看答案及解析
-
相同条件下,如果1 mol氢原子所具有的能量为E1,1mol氢分子的能量为E2。下列关系中正确的是
A.2E1=E2 B.2E1>E2 C.2E1<E2 D.E1=E2
难度: 中等查看答案及解析
-
金刚石与石墨是碳元素的两种结构不同的单质,彼此互称同素异形体。在100 kPa时,1 mol石墨转化为金刚石要吸收1.895 kJ的热能。据此判断在100 kPa压强下,下列说法正确的是
A.金刚石比石墨更稳定
B.石墨比金刚石更稳定
C.1 mol金刚石比1 mol石墨的总能量低
D.1 mol金刚石转变为石墨需要吸收1.895 kJ能量
难度: 中等查看答案及解析
-
已知单位体积的稀溶液中,非挥发性溶质的分子或离子数越多,该溶液的沸点就越高。则下列溶液沸点最高的是( )
A.0.01mol/L的蔗糖溶液 B.0.01mol/L的MgCl2溶液
C.0.02mol/L的H2S溶液 D.0.02mol/L的NaNO3溶液
难度: 简单查看答案及解析
-
《天工开物》中对制造染料“蓝靛”的叙述如下:“凡造淀,叶与茎多者入窖,少者入桶与缸。水浸七日,其汁自来。每水浆一石,下石灰五升,搅冲数十下,淀信即结。水性定时,淀沉于底…其掠出浮沫晒干者曰靛花。”文中没有涉及的实验操作是
A. 溶解 B. 搅拌 C. 升华 D. 蒸发
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值。下列说法正确的是
A.1 mol N2含有的N原子数为2NA
B.27 g Al变为Al3+时失去的电子数为NA
C.1 L 1 mol·L−1MgCl2溶液中含有的Cl−数为NA
D.常温常压下,11.2 L CO2中含有的原子数为1.5NA
难度: 中等查看答案及解析
-
下列物质中属于非电解质的是( )
A.
B.NaOH C.
D.
难度: 中等查看答案及解析
-
下列各组离子能在酸性溶液中大量共存的是( )
A.Na+、Fe2+、NH
、SO
B.Na+、Ca2+、Cl-、ClO-
C.Mg2+、Ba2+、CO
、SO
D.K+、NH
、Cl-、HCO
难度: 简单查看答案及解析
-
短周期元素A、B、C的位置如图所示,已知B、C两元素的原子序数之和是A元素原子序数的4倍,则A、B、C依次是( )
A.Be、Na、Al B.C、Al、P
C.B、Mg、Si D.O、P、Cl
难度: 简单查看答案及解析
-
我国的纳米基础研究能力已跻身于世界前列,曾制得一种合成纳米材料,其化学式为RN(N为氮元素,且为-3价)。已知该化合物中的Rn+核外有28个电子,则R元素位于元素周期表的( )
A.第3周期第ⅤA族 B.第4周期第ⅢA族
C.第5周期第ⅢA族 D.第4周期第ⅤA族
难度: 简单查看答案及解析
-
能说明Cl比S的非金属性强是
①Cl2比S容易与H2化合;
②Cl2能从Na2S溶液中置换出S;
③HClO3酸性比H2SO3的酸性强;
④与Fe反应时Cl2能生成高价铁化合物,S只能生成低价铁化合物;
⑤Cl2熔沸点比S的低。
A.只有④ B.①②④ C.①②③④ D.①②③④⑤
难度: 中等查看答案及解析