-
化学与生活密切相关。下列叙述错误的是( )
A.传播新冠病毒的气溶胶具有胶体性质
B.硫酸亚铁可用作袋装食品的脱氧剂
C.用水玻璃浸泡过的纺织品可防火
D.食用单晶冰糖的主要成分是单糖
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.28g乙烯与丙烯组成的混合物中含碳碳双键的数目为NA
B.2mol冰醋酸与4mol乙醇一定条件下充分反应,生成乙酸乙酯个数为2NA
C.室温时,1.0LpH=13的Ba(OH)2溶液中含有OH-的数目为0.1NA
D.标准状况下11.2LCl2溶于水,溶液中Cl-、ClO-和HClO的微粒数之和为NA
难度: 中等查看答案及解析
-
关于有机物a(
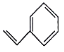 )、b(
)、b( )、c(
)、c( )的说法错误的是
)的说法错误的是A. a、b、c互为同分异构体
B. a、c均能使酸性高锰酸钾溶液褪色
C. a、c与足量氢气反应消耗氢气的物质的量之比是4∶3
D. a、b、c的一氯代物分别有4种、1种、2种(不考虑立体异构)
难度: 中等查看答案及解析
-
X、Y、Z、W是原子序数依次增大的短周期元素,且X、Z原子序数之和是Y、W原子序数之和的1/2。甲、乙、丙、丁是由这些元素组成的二元化合物,M是某种元素对应的单质,乙和丁的组成元素相同,且乙是一种“绿色氧化剂”,化合物N是具有漂白性的气体(常温下)。上述物质间的转化关系如图所示(部分反应物和生成物省略)。下列说法正确的是
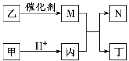
A.原子半径:r(Y)>r(Z)>r(W)
B.化合物N与乙烯均能使溴水褪色,且原理相同
C.含W元素的盐溶液可能显酸性、中性或碱性
D.Z与X、Y、W形成的化合物中,各元素均满足8电子结构
难度: 中等查看答案及解析
-
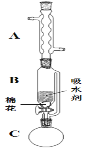
某同学分别用下列装置a和b制备溴苯,下列说法错误的是
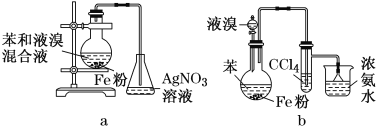
A.两烧瓶中均出现红棕色气体,说明液溴沸点低
B.a装置锥形瓶中出现淡黄色沉淀,说明烧瓶中发生取代反应
C.b装置试管中CCl4吸收Br2,液体变红棕色
D.b装置中的倒置漏斗起防倒吸作用,漏斗内形成白烟
难度: 简单查看答案及解析
-
利用CH4燃料电池电解制备Ca(H2PO4)2并得到副产物NaOH、H2、Cl2,装置如图所示。下列说法不正确的是( )
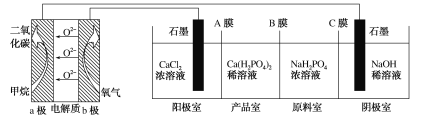
A.a极反应:CH4-8e-+4O2-=CO2+2H2O
B.A膜和C膜均为阴离子交换膜
C.可用铁电极替换阴极的石墨电极
D.a极上通入标况下2.24L甲烷,阳极室Ca2+减少0.4mol
难度: 中等查看答案及解析
-
已知
。室温下用
的
滴定
某一元酸
的结果如图所示,下列说法中正确的是
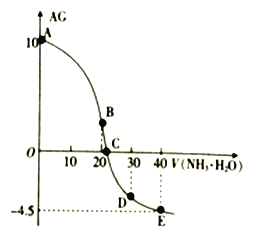
A.
属于弱酸
B.整个过程中,
点时水的电离程度最大
C.
点对应液中
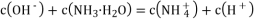
D.
的数量级为
难度: 中等查看答案及解析
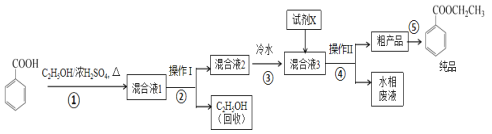
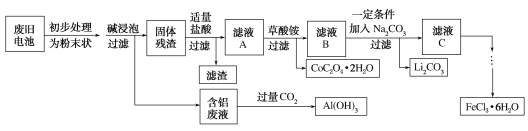
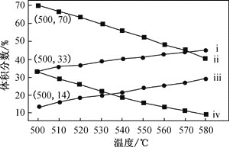
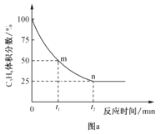


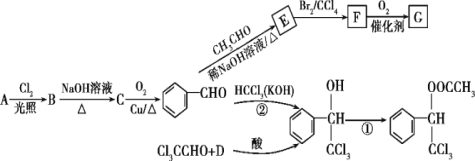
 是一种重要的药物中间体,其合成路线与G相似,请以
是一种重要的药物中间体,其合成路线与G相似,请以