-
化学与生产、生活密切相关。下列事实与化学反应速率无关的( )
A. 食品、蔬菜贮存在冰箱和冰柜里,能延长保鲜时间
B. 家用铁锅、铁铲等餐具保持干燥,能减缓生锈
C. 制造蜂窝煤时加入生石灰,减少SO2排放
D. 煤气换成天然气时,要调整灶具进气(或出气)管
难度: 简单查看答案及解析
-
已知:C(s)+ H2O(g)== CO(g) + H2(g) △H = a kJ·mol-1
2 C(s)+ O2(g)== 2CO(g) △H = -220 kJ·mol-1
H-H 、O=O和O-H键的键能(kJ·mol-1)分别为436、496和462,则a为( )
A.-332 B.-118 C.+350 D.+130
难度: 中等查看答案及解析
-
下列不属于自发进行的变化是 ( )
A.红墨水加到清水使整杯水变红 B.冰在室温下融化成水
C.NaHCO3 转化为 Na2CO3 D.铁器在潮湿的空气中生锈
难度: 简单查看答案及解析
-
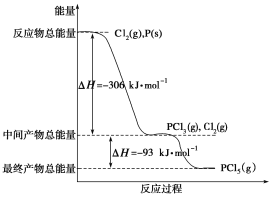
在下列反应中,反应物的总能量低于生成物的总能量的是
A.2H2+O2
2H2O B.CaCO3
CaO+CO2↑
C.CaO+CO2=CaCO3 D.C2H5OH+3O2
2CO2+3H2O
难度: 简单查看答案及解析
-
下列热化学方程式中,ΔH能正确表示物质的燃烧热的是
A.C(s)+
O2(g)===CO(g) ΔH=-110.5kJ·mol-1
B.CO(g)+
O2(g)===CO2(g) ΔH=-283.0kJ·mol-1
C.H2(g)+
O2(g)===H2O(g) ΔH=-241.8kJ·mol-1
D.2C8H18(l)+25O2(g)===16CO2(g)+18H2O(l) ΔH=-11036kJ·mol-1
难度: 简单查看答案及解析
-
反应A(g)+3B(g)
2C(g)+2D(g)在四种不同情况下的反应速率如下,其中表示反应速率最快的是
A.v(D)=0.45mol·L-1·min-1 B.v(B)=0.01mol·L-1·s-1
C.v(C)=0.40mol·L-1·min-1 D.v(A)=0.15mol·L-1·min-1
难度: 简单查看答案及解析
-
相同体积、相同氢离子浓度的强酸溶液和弱酸溶液分别跟足量的镁完全反应,下列说法正确的是( )
A.弱酸溶液产生较多的氢气
B.强酸溶液产生较多的氢气
C.两者产生等量的氢气
D.无法比较两者产生氢气的量
难度: 简单查看答案及解析
-
在CH3COOH
H++CH3COO-的电离平衡中,要使电离平衡右移且氢离子浓度增大,应采取的措施是
A.加入NaOH B.加入盐酸
C.加水 D.升高温度
难度: 简单查看答案及解析
-
一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合题图10 的是
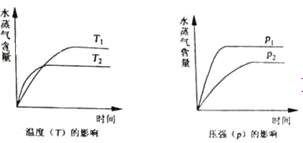
A.CO2(g)+2NH3(g)
CO(NH2)2(s)+H2O(g);△H<0
B.CO2(g)+H2(g)
CO(g)+H2O(g);△H>0
C.CH3CH2OH (g)
CH2=CH2(g)+H2O(g);△H>0
D.2C6H5CH2CH3(g)+O2(g)
2 C6H5CH=CH2(g)+2H2O(g);△H<0
难度: 中等查看答案及解析
-
肼(N2H4)是火箭发动机的燃料,它与N2O4反应时,N2O4为氧化剂,生成氮气和水蒸气。已知:①N2(g)+2O2(g)=N2O4(g)ΔH=+8.7kJ·mol-1;②N2H4(g)+O2(g)=N2(g)+2H2O(g)ΔH=-534.0kJ·mol-1;下列表示肼跟N2O4反应的热化学方程式正确的是
A.2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)ΔH=-542.7kJ·mol-1
B.2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)ΔH=-1059.3kJ·mol-1
C.N2H4(g)+
N2O4(g)=
N2(g)+2H2O(g)ΔH=-1076.7kJ·mol-1
D.2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)ΔH=-1076.7kJ·mol-1
难度: 中等查看答案及解析
-
100℃时,将0.1molN2O4置于1L密闭的烧瓶中,然后将烧瓶放入100℃的恒温槽中,烧瓶内的气体逐渐变为红棕色:N2O4(g)
2NO2(g)。下列结论不能说明上述反应在该条件下已经达到平衡状态的是)
①N2O4的消耗速率与NO2的生成速率之比为1:2
②NO2生成速率与NO2消耗速率相等
③烧瓶内气体的压强不再变化
④烧瓶内气体的质量不再变化
⑤NO2的物质的量浓度不再改变
⑥烧瓶内气体的颜色不再加深
⑦烧瓶内气体的平均相对分子质量不再变化
⑧烧瓶内气体的密度不再变化
A.①④⑧ B.②③⑤⑥⑦ C.只有①④ D.只有⑦⑧
难度: 中等查看答案及解析
-
下列事实不能用勒夏特列原理解释的是
A. 硫酸工业中使用五氧化二钒做催化剂
B. 实验室利用排饱和食盐水的方法来收集氯气
C. 工业合成氨,采用高压条件
D. 保持恒温恒容,反应2HI(g)
H2(g)+I2(g)平衡后,加入氢气体系颜色变浅
难度: 中等查看答案及解析
-
下图是可逆反应A+2B
2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断
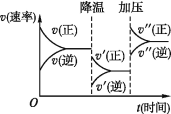
A. 正反应是吸热反应
B. 若A、B是气体,则D是液体或固体
C. 逆反应是放热反应
D. A、B、C、D均为气体
难度: 中等查看答案及解析
-
已知:Cu(s)+2H+(aq)=Cu2+(aq)+H2(g) △H1
2H2O2(l)=2H2O(l)+O2(g) △H2
2H2(g)+O2(g)=2H2O(l) △H3
则反应Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l))的△H是( )
A. △H=△H1+1/2△H2+1/2△H3
B. △H=△H1+1/2△H2-1/2△H3
C. △H=△H1+2△H2+2△H3
D. △H=2△H1+△H2+△H3
难度: 中等查看答案及解析
-
对于化学反应能否自发进行,下列说法中错误的是( )
A.若ΔH<,ΔS>0,任何温度下都能自发进行
B.若ΔH>0,ΔS<0,任何温度下都不能自发进行
C.若ΔH>0,ΔS>0,低温时可自发进行
D.若ΔH<0,ΔS<0,低温时可自发进行
难度: 中等查看答案及解析
-
氢气用于烟气的脱氮、脱硫的反应:4H2(g)+2NO(g)+SO2(g)
N2(g)+S(l)+4H2O(g)ΔH<0。下列有关说法正确的是( )
A.当v(H2)=v(H2O)时,达到平衡
B.升高温度,正反应速率减小,逆反应速率增大,化学平衡逆向移动
C.使用高效催化剂可提高NO的平衡转化率
D.化学平衡常数表达式为K=
难度: 简单查看答案及解析