-
2019年江西南昌“海昏侯墓”出土了一件青铜白酒蒸馏器。下列说法不正确的是( )
A.在实验室进行蒸馏时,必须使用圆底烧瓶、直形冷凝管、酒精灯、锥形瓶等仪器
B.我国古代人民常用明水矾除去铜器表面的铜绿(铜锈)
C.青铜文物和铁质文物在潮湿的土壤环境中容易发生电化学腐蚀
D.与火法冶铜(以Cu2S为原料)相比,采用湿法冶铜(以CuSO4为原料)的优点是减少了环境污染和能源的消耗
难度: 中等查看答案及解析
-
我国科学家将LiClO4溶于有机溶剂作为惰性电解质,使用溶剂热合成法将钌(Ru)纳米颗粒沉积在导电碳黑(SuperP)上。所得材料Ru@SuperP用作Li—CO2二次电池中的正极。电池的总反应为:3CO2+4Li=2Li2CO3+C。下列说法正确的是( )
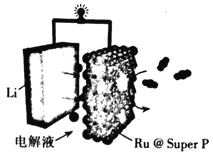
A.放电时,ClO
向正极移动
B.充电时.阳极反应为:2Li2CO3+C-4e-=3CO2↑+4Li+
C.该电池电解液中的LiClO4可以用LiCl水溶液替换
D.放电时溶液中每转移4mol电子时吸收CO2气体67.2L
难度: 中等查看答案及解析
-
研究表明连花清瘟制剂中的金丝桃苷是对新冠病毒主要蛋白酶最可能的抑制剂。其结构如图所示。下列说法错误的是( )
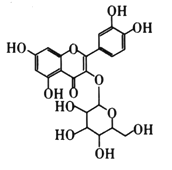
A.金丝桃的苷分子式为C21H20O12
B.金丝桃苷中所有碳原子不可能在同一平面上
C.金丝桃苷既能发生取代反应、氧化反应,还能使溴的四氯化碳溶液褪色
D.
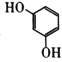 苯环上的二氯代物有5种
苯环上的二氯代物有5种难度: 简单查看答案及解析
-
一种玉石主要成分的化学式为Z2X10W12Y30,其中X、Y、Z、W均为短周期主族元素且原子序数依次增大,X与Z位于同一主族,Y与X位于同一周期。X、W、Z原子的最外层电子数之和等于Y原子的最外层电子数,且Y是地壳中含量最多的元素。下列说法错误的是( )
A.原子半径:Z>W>Y
B.最高价氧化物对应水化物的碱性:Z>X
C.这四种元素与氢元素只能形成4种二元化合物
D.Y、W组成的常见化合物中只含有极性键且能与NaOH溶液反应
难度: 困难查看答案及解析
-
“化学多米诺实验”是只需控制第一个反应,就能使若干化学实验依次发生,如图所示。已知:①Cu2++4NH3•H2O=4H2O+[Cu(NH3)4]2+(该反应产物可作为H2O2的催化剂);②已知装置A、C中所用硫酸的浓度相同,装置B、D中所用金属锌的质量完全相同
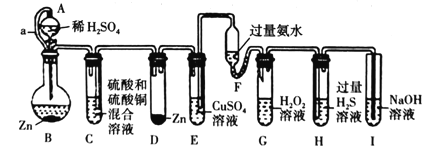
下列说法错误的是( )
A.该实验成功的关键条件是整套装置的气密性良好
B.因为形成原电池,所以装置D中生成氢气的反应速率一定大于B
C.导管a的作用是平衡A和B内气压
D.装置H中出现浅黄色浑浊,可证明非金属性:O>S
难度: 中等查看答案及解析
-
2020年3月10日,习近平总书记赴湖北武汉考察新冠疫情工作,给奋战在抗疫一线的战士们、武汉乃至全国人民极大的鼓舞。下列说法错误的有( )
①用于消毒的酒精、“84”消毒液、双氧水、过氧乙酸(CH3COOOH)等均属于有机物
②95%的酒精比75%的酒精杀菌效果好
③“84”消毒液露置在空气中不会变质
④双氧水能使酸性高锰酸钾溶液和溴水褪色,其褪色原理均为氧化还原反应
⑤修建“火神山”医院所用的HDPE(高密度聚乙烯)膜是一种无毒、无味的高分子材料
⑥医用外科口罩和防护服所用的熔喷布是一种聚丙烯材料,聚丙烯可以使溴水褪色
⑦科研人员积极研发抗击新型冠状病毒的疫苗,疫苗一般应冷藏存放,以避免蛋白质变性
⑧N95口罩用0.3µmNaCl颗粒进行测试,阻隔率达95%以上,戴N95口罩可有效阻隔PM2.5
⑨过氧乙酸和乙酸属于同系物
A.6项 B.5项 C.4项 D.3项
难度: 中等查看答案及解析
-
室温下,用0.1000mol•L-1NaOH溶液滴定20mL0.1000mol•L-1H3PO4溶液,溶液的pH与所加NaOH溶液的体积关系如图所示。下列说法不正确的是( )
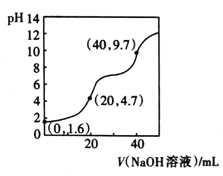
A.H3PO4的电离平衡常数Ka1约为10-2
B.当V(NaOH溶液)=40mL时,c(PO
)+c(OH-)=c(H+)+c(H2PO
)+2c(H3PO4)
C.当pH=7时,c(Na+)=c(H2PO
)+2c(HPO
)+3c(PO
)
D.当V(NaOH溶液)=20mL时,c(Na+)>c(H2PO
)>c(H3PO4)>c(HPO
)
难度: 困难查看答案及解析
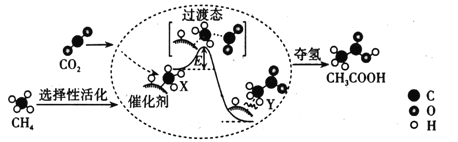
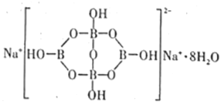
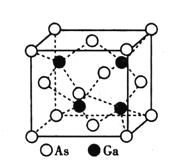
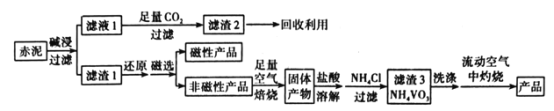
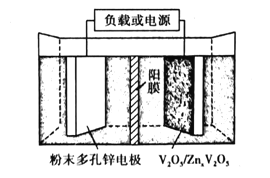
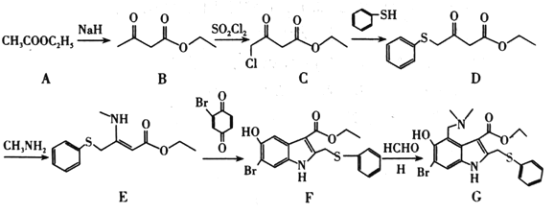
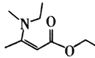 的路线(不超过4步):___。
的路线(不超过4步):___。