-
CO2是地球上取之不尽用之不竭的碳源,将CO2应用于生产中实现其综合利用是目前的研究热点。
(1)由CO2转化为羧酸是CO2资源化利用的重要方法。
I.在催化作用下由CO2和CH4转化为CH3COOH的反应历程示意图如图。
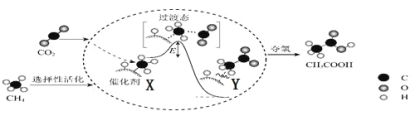
①在合成CH3COOH的反应历程中,下列有关说法正确的是_____。(填字母)
a.该催化剂使反应的平衡常数增大
b.CH4→CH3COOH过程中,有C—H键发生断裂
c.由X→Y过程中放出能量并形成了C—C键
②该条件下由CO2和CH4合成CH3COOH的化学方程式为_____。
II.电解法转化CO2制HCOOH的原理如图。
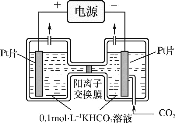
①写出阴极CO2还原为HCOO-的电极反应式:_____。
②电解一段时间后,阳极区的KHCO3溶液浓度降低,其原因是_____。
(2)由CO2合成甲醇是CO2资源化利用的重要方法。研究表明在催化剂作用下CO2和H2可发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH
CH3OH(g)+H2O(g) ΔH
①有利于提高合成CH3OH反应中CO2的平衡转化率的措施有_____。(填字母)
a.使用催化剂 b.加压 c.增大初始投料比
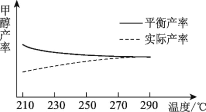
②研究温度对于甲醇产率的影响。在210℃~290℃保持原料气中CO2和H2的投料比不变,得到甲醇的实际产率、平衡产率与温度的关系如图所示。ΔH____0(填“>”或“<”),其依据是____。
-
CO2是地球上取之不尽用之不竭的碳源,将CO2应用于生产中实现其综合利用是目前的研究热点。
(1)CO2加氢制备甲酸(HCOOH,熔点8.4℃沸点100.8℃)是利用化学载体进行H2储存的关键步骤。
已知:H2(g)+CO2(g) HCOOH(l) △H1=-30.0kJ•mol-1
HCOOH(l) △H1=-30.0kJ•mol-1
2H2(g)+O2(g)=2H2O(1) △H2=-571.6kJ•mol-1
则表示HCOOH燃烧热的热化学方程式为___。
(2)在催化作用下由CO2和CH4转化为CH3COOH的反应历程示意图如图。
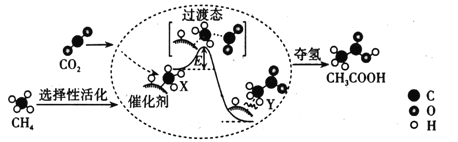
①在合成CH3COOH的反应历程中,下列有关说法正确的是___。填(字母)
a.该催化剂使反应的平衡常数增大
b.CH4→CH3COOH过程中,有C—H键发生断裂
c.由X→Y过程中放出能量并形成了C—C键
②该条件下由CO2和CH4合成CH3COOH的化学方程式为___。
(3)CO2与H2在一定条件下反应可生成甲醇:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H<0。改变温度时,该反应中的所有物质都为气态,起始温度、容积均相同(T1℃、2L密闭容器)。实验过程中的部分数据见下表:
CH3OH(g)+H2O(g) △H<0。改变温度时,该反应中的所有物质都为气态,起始温度、容积均相同(T1℃、2L密闭容器)。实验过程中的部分数据见下表:
| 反应时间 | n(CO2)/mol | n(H2)/mol | n(CH3OH)/mol | n(H2O)/mol |
| 实验I恒温恒容 | 0min | 2 | 6 | 0 | 0 |
| 10min | | 4.5 | | |
| 20min | 1 | | | |
| 30min | | | 1 | |
| 实验II绝热恒容 | 0min | 0 | 0 | 2 | 2 |
①实验I,前10min内的平均反应速率υ(CH3OH)=___。
②平衡时CH3OH的浓度:c(实验I)___c(实验II)(填“>”、“<”或“=”,下同)。实验I中当其他条件不变时,若30min后只改变温度为T2℃,再次平衡时n(H2)=3.2mol,则T1___T2。
③已知某温度下该反应的平衡常数K=160,开始时在密闭容器中只加入CO2和H2,反应10min时测得各组分的浓度如下表,则此时υ正___υ逆。
| 物质 | H2 | CO2 | CH3OH | H2O |
| 浓度/(mol·L-1) | 0.2 | 0.2 | 0.4 | 0.4 |
-
CO2是地球上取之不尽用之不竭的碳源,捕集、利用 CO2 始终是科学研究的热点。
⑴新的研究表明,可以将 CO2 转化为炭黑回收利用,反应原理如图所示。
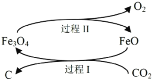
①整个过程中 FeO 的作用是_____________;
②写出 CO2 转化为炭黑的总反应化学方程式_____________。
⑵由CO2 合成甲醇是CO2资源化利用的重要方法。
研究表明在催化剂作用下CO2 和H2可发生反应:CO2(g) + 3H2(g) CH3OH(g) + H2O(g) ΔH
CH3OH(g) + H2O(g) ΔH
①有利于提高合成CH3OH反应中CO2的平衡转化率的措施有_______。(填字母)
a.使用催化剂 b.加压 c.增大初始投料比n(CO2 )/ n(H2)
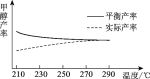
②研究温度对于甲醇产率的影响。在210 ℃~290 ℃,保持原料气中CO2和H2的投料比不变,得到甲醇的实际产率、平衡产率与温度的关系如下图所示。ΔH____0(填“>”或“<”),其依据是_______。
⑶工业用二氧化碳加氢可合成乙醇: 保持压强为5MPa,向密闭容器中投入一定量CO2和H2发生上述反应,CO2的平衡转化率与温度、投料比
保持压强为5MPa,向密闭容器中投入一定量CO2和H2发生上述反应,CO2的平衡转化率与温度、投料比 的关系如图所示。
的关系如图所示。
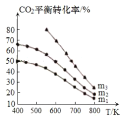
①该反应平衡常数的表达式为_________________。
②投料比m1、m2、m3由大到小的顺序为 _________________。
-
研究表明丰富的CO2完全可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)到本世纪中叶将枯竭的危机,同时又可缓解由CO2累积所产生的温室效应,实现CO2的良性循环。
(1)目前工业上有一种方法是用CO2和H2在230℃催化剂条件下转化生成甲醇蒸汽和水蒸气。下图表示恒压容器中0.5 mol CO2和1.5 mol H2转化率达80%时的能量变化示意图。
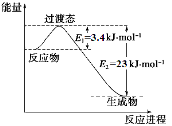
①写出该反应的热化学方程式: 。
②能判断该反应达到化学平衡状态的依据是 。
a.容器中压强不变 b.H2的体积分数不变
c.c(H2)=3c(CH3OH) d.容器中密度不变
e.2个C=O断裂的同时有6个H-H断裂。
(2)人工光合作用能够借助太阳能,用CO2和H2O制备化学原料.下图是通过人工光合作用制备HCOOH原理的示意图。根据要求回答问题:
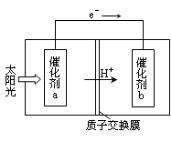
①该过程是将 转化为 。(以上两空选填“电能”“太阳能”“化学能”)
②催化剂b表面的电极反应方程式为 。
(3)某国科研人员提出了使用氢气和汽油(汽油化学式用C8H18表示)混合燃料的方案,以解决汽车CO2的排放问题。该方案主要利用储氢材料CaH2产生H2和用汽油箱贮存汽油供发动机使用,储氢系统又捕集汽油燃烧产生的CO2,该系统反应如下图所示:
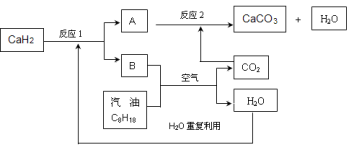
解决如下问题:
①写出CaH2的电子式 。
②反应1中氧化剂与还原剂的物质的量之比是: 。
③如该系统反应均进行完全,试写出该系统总反应的化学方程式 。
-
研究表明丰富的CO2完全可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)到本世纪中叶将枯竭的危机,同时又可缓解由CO2累积所产生的温室效应,实现CO2的良性循环。
(1)目前工业上有一种方法是用CO2和H2在230℃催化剂条件下转化生成甲醇蒸汽和水蒸气。下图表示恒压容器中0.5 mol CO2和1.5 mol H2转化率达80%时的能量变化示意图。
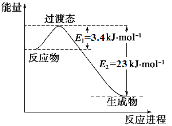
①写出该反应的热化学方程式: 。
②能判断该反应达到化学平衡状态的依据是 。
a.容器中压强不变 b.H2的体积分数不变
c.c(H2)=3c(CH3OH) d.容器中密度不变
e.2个C=O断裂的同时有6个H-H断裂。
(2)人工光合作用能够借助太阳能,用CO2和H2O制备化学原料.下图是通过人工光合作用制备HCOOH原理的示意图。根据要求回答问题:
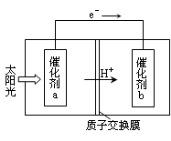
①该过程是将 转化为 。(以上两空选填“电能”“太阳能”“化学能”)
②催化剂b表面的电极反应方程式为 。
(3)某国科研人员提出了使用氢气和汽油(汽油化学式用C8H18表示)混合燃料的方案,以解决汽车CO2的排放问题。该方案主要利用储氢材料CaH2产生H2和用汽油箱贮存汽油供发动机使用,储氢系统又捕集汽油燃烧产生的CO2,该系统反应如下图所示:
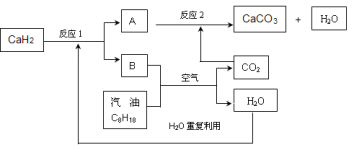
解决如下问题:
①写出CaH2的电子式 。
②反应1中氧化剂与还原剂的物质的量之比是: 。
③如该系统反应均进行完全,试写出该系统总反应的化学方程式 。
-
(14分)
研究表明丰富的CO2完全可以作为新碳源,解决当前应用最广泛的碳 源(石油和天然气)到本世纪中叶将枯竭的危机,同时又可缓解由CO2累积所产生的温室效应,实现CO2的良性循环。
(1)目前工业上有一种方法是用CO2和H2在230℃催化剂条件下转化生成甲醇蒸汽和水蒸气。下图表示恒压容器中0.5 mol CO2和1.5 mol H2转化率达80%时的能量变化示意图。能判断该反应达到化学平衡状态的依据是_____________。
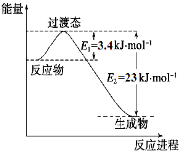
a.容器中压强不变
b.H2的体积分数不变
c.c(H2)=3c(CH3OH)
d.容器中密度不变
e.2个C=O断裂的同时有6个H-H断裂。
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应
CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度℃ | 起始量/mol[ | 平衡量/mol | 达到平衡所需 时间/min |
| CO | H2O | H2 | CO |
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
| | | | | | |
①实验2条件下平衡常数K= 。
②实验3中,若平衡时,CO的转化率大于水蒸气,则a/b 的值______(填具体值或取值范围)。
③实验4,若900℃时,在此容器中加入CO、H2O、CO2 、H2均为1mol,则此时V正 V逆(填“<”,“>”,“=”)。
(3)已知在常温常压下:
①2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH=-1275.6 kJ/mol
②2CO (g)+ O2(g) = 2CO2(g) ΔH=-566.0 kJ/mol
③H2O(g) = H2O(l) ΔH=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式: 。
(4)已知草酸是一种二元弱酸,草酸氢钠(NaHC2O4)溶液显酸性。常温下,向10 mL 0.01 mol·L-1 H2C2O4溶液中滴加10mL 0.01mol·L-1 NaOH溶液时,比较溶液中各种离子浓度的大小关系 ;
(5)以甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。该电池的负极反应式为________;
-
实现节能减排和低碳经济的一项重要课题就是研究如何将CO2转化为可利用的资源,目前工业上有一种方法是用CO2来生产燃料甲醇,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ/mol ) 的变化,据此回答下列有关问题:
CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ/mol ) 的变化,据此回答下列有关问题:
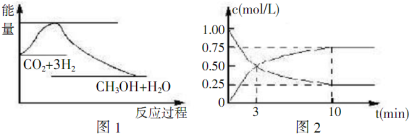
(1)25℃时,1.01×105Pa,16g液态甲醇完全燃烧,当恢复到原状态时放出363.3kJ的热量,写出该反应的热化学方程式______________。
(2)为探究反应原理,现进行如下实验:某温度下,在体积为lL的密闭容器中充入lmolCO2和4molH2,一定条件下发生反应CO2(g)+3H2(g) CH3OH(g)+H2O(g),测得CO2的浓度随时间变化如上图2所示.
CH3OH(g)+H2O(g),测得CO2的浓度随时间变化如上图2所示.
①从反应开始到平衡,CH3OH的平均反应速率v(CH3OH)=______________;H2的转化率为______________.
②若向该容器中加入 amolCO2、bmolH2、cmolCH3OH(g)和dmolH2O(g),且a、b、c、d均大于0,在相同条件下达到平衡时,混合物中各组分的物质的量与上述平衡相同,试比较反应放出的能量:①______________②(填“大于”“小于” 或“等于”)
③下列措施中能使H2的转化率提高的是______________(填字母)。
A.升高温度 B.将CH3OH(g)及时液化抽出
C.选择高效催化剂 D.相同条件下 再充入lmolCO2和4molH2
(3)甲醇是一种可再生能源具有广泛的开发和应用前景。某实验小组用一种以甲醇为原料的燃料电池作为电源,设计了一种电解法制取Fe(OH)2的实验装置如(下图所示),通电后溶液中产生大量白色沉淀且较长时间不变色。
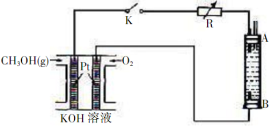
①该燃料电池的负极反应为______________。
②下列说法中正确的是______________(填序号)
A.电源中的负极附近 pH升高
B.电极B的发生氧化反应
C.A、B两端都必须用铁作电极
D.阴极发生的反应是2H++2e-=H2↑
E.电解的电解质溶液可以是CuSO4溶液
③若电池中甲醇的通入量为8g,且反应完全,则理论上最多能产生沉淀______________g。
-
实现“低碳经济”的一项重要课题就是研究如何将CO2转化为可利用的资源。因此,研究CO2 的综合利用对“低碳社会”的构述构建具有重要意义。
(1)一定条件下CO2可以和铁反应:Fe(s)+CO2(g) FeO(s)+CO(g),该反应的平衡常数(K)与温度(T)的关系如图甲所示:
FeO(s)+CO(g),该反应的平衡常数(K)与温度(T)的关系如图甲所示:
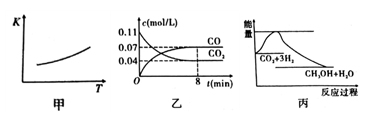
①该反应的△H______0(填“<”、“=”或“>”)。
②下列措施,能使平衡时 增大的是______(填序号)。
增大的是______(填序号)。
A.充入一定量的CO B.升高温度 C.使用催化剂
③一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2,反应过程中CO2和CO的物质的量浓度与时间的关系如图乙所示。该反应的平衡常数K=_____________。
(2)目前工业上有一种方法是用CO2来生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),图丙表示该反应过程中能量的变化。
CH3OH(g)+H2O(g),图丙表示该反应过程中能量的变化。
①下列关于该反应的说法,正确的是______(填序号)。
A.△H<0,△S<0 B.△H>0,△S<0 C.△H>0,△S>0 D.△H<0,△S>0
②已知:CO2(g)+3H2(g) CH3OH(l)+H2O(l) △H=-143.0kJ•mol-1;
CH3OH(l)+H2O(l) △H=-143.0kJ•mol-1;
H2(g)+  O2(g)=H2O(l) △H=-285.8kJ•mol-1。
O2(g)=H2O(l) △H=-285.8kJ•mol-1。
写出表示CH3OH燃烧热的热化学方程式:________________________________。
③一种以甲醇为原料的燃料电池,使用合适的合金为电极,以氢氧化钠溶液、甲醇、氧气为原料,该电池负极的电极反应式为_______________________________。
(3)以CO2为原料还可以合成多种氮肥。
①工业上由CO2和NH3在一定条件下合成尿素的化学方程式为CO2(g)+2NH3(g) CO(NH2)2(l)+H2O(g)。起始以
CO(NH2)2(l)+H2O(g)。起始以 =5投料进行反应,达到化学平衡时CO2的转化率为60%,则NH3的平衡转化率为______________。
=5投料进行反应,达到化学平衡时CO2的转化率为60%,则NH3的平衡转化率为______________。
②将足量CO2通入饱和氨水中可制得碳铵(NH4HCO3)。已知室温下Kb(NH3·H2O)=1.8×10-5,Kal(H2CO3)=4.3×10-7,则 0.lmol/LNH4HCO3 溶液呈_________(填“酸性”“中性”或“碱性”)。
-
2019年国际非政府组织“全球碳计划”12月4日发布报告:研究显示,全球二氧化碳排放量增速趋 缓。CO2的综合利用是解决温室问题的有效途径。
(1)一种途径是将CO2转化成有机物实现碳循环。如:

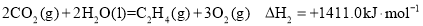
 △H3=____
△H3=____
(2)CO2甲烷化反应是由法国化学家Paul Sabatier提出的,因此,该反应又叫Sabatier反应。CO2催化氢化 制甲烷的研究过程如下:
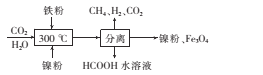
①上述过程中,产生H2反应的化学方程式为____
②HCOOH是CO2转化为CH4的中间体:CO2 HCOOH
HCOOH CH4。当镍粉用量增加10倍后,甲酸的产量迅速减少,当增加镍粉用量时,CO2镍催化氢化制甲烷的两步反应中反应速率增加较大的一步是_____填“I”或“Ⅱ”)。
CH4。当镍粉用量增加10倍后,甲酸的产量迅速减少,当增加镍粉用量时,CO2镍催化氢化制甲烷的两步反应中反应速率增加较大的一步是_____填“I”或“Ⅱ”)。
(3)CO2经催化加氢可以生成低碳烃,主要有两个竞争反应:
反应I: 
反应Ⅱ:
在1 L恒容密闭容器中充人1 mol CO2和4 mol H2,测得平衡时有关物质的物质的量随温度变化如图所示。T1℃时,CO2的转化率为____。T1℃时,反应I的平衡常数K= ___。
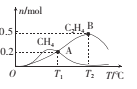
(4)已知CO2催化加氢合成乙醇的反应原理为 ,m代表起始时的投料比,即
,m代表起始时的投料比,即
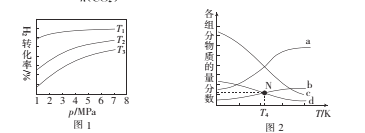
①图1中投料比相同,温度T3>T2>T1,则△H ______(填“>”或“<”)0。
②m=3时,该反应达到平衡状态后p(总)=20a MPa,恒压条件下各物质的物质的量分数与温度的关系如图2。则曲线b代表的物质为 ___(填化学式),T4温度时,反应达到平衡时物质d的分压p(d)=______
-
2019年国际非政府组织“全球碳计划”12月4日发布报告:研究显示,全球二氧化碳排放量增速趋于缓。CO2的综合利用是解决温室问题的有效途径。
(1)一种途径是将CO2转化为成为有机物实现碳循环。如:
C2H4 (g) + H2O (l) = C2H5OH (l) ΔH=-44.2 kJ·mol-1
2CO2(g) + 2H2O (l) =C2H4 (g) +3O2(g) ΔH=+1411.0 kJ·mol-1
2CO2(g) + 3H2O (l) = C2H5OH (l) + 3O2(g) ΔH=___________
(2)CO2甲烷化反应是由法国化学家Paul Sabatier 提出的,因此,该反应又叫Sabatier反应。CO2催化氢化制甲烷的研究过程:
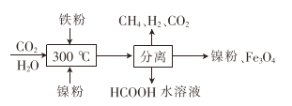
①上述过程中,产生H2反应的化学方程式为:___________________________________。
②HCOOH是CO2转化为CH4的中间体:CO2  HCOOH
HCOOH 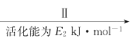 CH4。当镍粉用量增加10倍后,甲酸的产量迅速减少,当增加镍粉的用量时,CO2镍催化氢化制甲烷的两步反应中反应速率增加较大的一步是_______________(填I或II)
CH4。当镍粉用量增加10倍后,甲酸的产量迅速减少,当增加镍粉的用量时,CO2镍催化氢化制甲烷的两步反应中反应速率增加较大的一步是_______________(填I或II)
(3)CO2经催化加氢可以生成低碳烃,主要有两个竞争反应:
反应I:CO2(g) + 4H2 (g) CH4 (g) +2H2O(g)
CH4 (g) +2H2O(g)
反应II:2CO2(g) + 6H2 (g) C2H4 (g) +4H2O(g)
C2H4 (g) +4H2O(g)
在1L密闭容器中冲入1molCO2和4molH2,测得平衡时有关物质的物质的量随温度变化如图所示。T1℃时,CO2的转化率为_________。T1℃时,反应I的平衡常数K=_______。
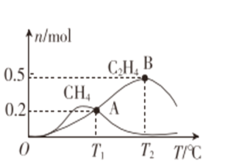
(4)已知CO2催化加氢合成乙醇的反应原理为2CO2(g) + 6H2 (g) C2H5OH (g) +4H2O(g) ΔH,m代表起始时的投料比,即m=
C2H5OH (g) +4H2O(g) ΔH,m代表起始时的投料比,即m= .
.
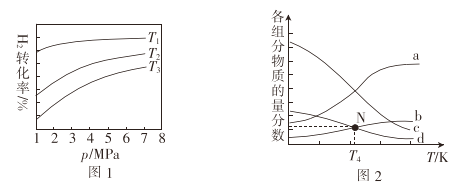
①图1中投料比相同,温度T3>T2>T1,则ΔH_____(填“>”或“<”)0.
②m=3时,该反应达到平衡状态后p(总)=20ɑ MPa ,恒压条件下各物质的物质的量分数与温度的关系如图2.则曲线b代表的物质为_______(填化学式)
HCOOH(l) △H1=-30.0kJ•mol-1

CH3OH(g)+H2O(g) △H<0。改变温度时,该反应中的所有物质都为气态,起始温度、容积均相同(T1℃、2L密闭容器)。实验过程中的部分数据见下表:
















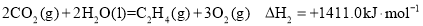




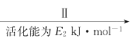 CH4。当镍粉用量增加10倍后,甲酸的产量迅速减少,当增加镍粉的用量时,CO2镍催化氢化制甲烷的两步反应中反应速率增加较大的一步是_______________(填I或II)
CH4。当镍粉用量增加10倍后,甲酸的产量迅速减少,当增加镍粉的用量时,CO2镍催化氢化制甲烷的两步反应中反应速率增加较大的一步是_______________(填I或II)
