-
前四周期六种元素 Q、R、X、Y、Z、W 的原子序数依次递增。已知:①Z 的 d 轨道和 s 轨道都是半充满,W 的 d 轨道和 s 轨道都是全满,其余元素均为短周期主族元素;Y 原子的价电子(外围电子)排布为 msnmpn;②R 原子核外 L 层电子数为奇数;③Q、X 原子 p 轨道的电子数分别为 2 和 4。请回答下列问题:
(1)第一电离能:I1(R)_______________I1(X)(填“>”或“<”或“=”),原因是__________________________
(2)在[W(NH3)4]2+离子中,配体是_____________,1 mol 该配离子中含有 σ 键的物质的量为_______________mol。
(3) Q 与 Y 形成的最简单气态氢化物分别为甲、乙,下列判断正确的是_______________。
a.稳定性:甲>乙,沸点:甲>乙 b.稳定性:甲>乙,沸点:甲<乙
c.稳定性:甲<乙,沸点:甲<乙 d.稳定性:甲<乙,沸点:甲>乙
(4)Q 的一种氢化物相对分子质量为 26,下列叙述正确的是_______________
a.中心原子是 sp1 杂化 b.该分子既含极性键又含非极性键
c.该分子只含σ键 d.该分子极易溶于水
(5)元素 Z 属于_______________区元素,电子排布式是_______________。
-
短周期五种元素 A、B、C、D、E,原子序数依次增大。已知:A 原子的核外电子数与电子层数相等;B 元素原子的核外 p 电子数比 s 电子数少 1 个;C 原子的第一至第四电离能为 I1=738 kJ·mol-1,I2=1 451 kJ·mol-1,I3=7 733 kJ·mol-1,I4=10 540 kJ·mol-1;D 原子核外所有 p 轨道为全充满或半充满;E 元素的族序数与周期序数的差为 4。
(1)写出 C 单质在 B 单质中燃烧的化学方程式:_______________________________________。
(2)某同学根据题目信息和掌握的知识分析 C 的核外电子排布为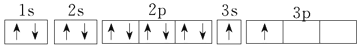 该同学所画的轨道式违背了_______________原理(或规则)。
该同学所画的轨道式违背了_______________原理(或规则)。
(3)用电子式表示 BA3 的形成过程:__________________________。
(4)DE3 中心原子杂化方式为_______________,其空间构型为_______________。
-
(1)某元素的全部电离能(单位:eV)如下:
| I1 | I2 | I3 | I4 | I5 | I6 | I7 | I8 |
| 13.6 | 35.1 | 54.9 | 77.4 | 113.9 | 138.1 | 739.1 | 871.1 |
写出该元素价电子轨道表示式_______________。
(2)分子中的大π 键可用符号 表示,其中 m 代表参与形成大 π 键的原子数,n 代表参与形成大π 键的电子数,如苯分子中的大 π 键可表示为
表示,其中 m 代表参与形成大 π 键的原子数,n 代表参与形成大π 键的电子数,如苯分子中的大 π 键可表示为 。
。
①试判断 SO2 最外层一共有_______________对孤对电子。
②HN3称为叠氮酸,常温下为无色有刺激性气味的液体。N3-的键角为_______________,N 中的大π 键应表示为_______________。
中的大π 键应表示为_______________。
(3)根据对角线规则,Be、Al 的化学性质相似,写出 Be(OH)2 与 NaOH 反应的离子方程式是________________________________。
的中心原子均为sp3杂化
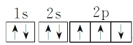 此图错误,违背了泡利原理
此图错误,违背了泡利原理 该同学所画的轨道式违背了_______________原理(或规则)。
该同学所画的轨道式违背了_______________原理(或规则)。