-
X、Y、Z为短周期元素,X原子最外层只有一个电子,Y原子的最外层电子数比内层电子总数少4,Z原子的最外层电子数是内层电子总数的3倍。下列有关叙述正确的是( )
A.Y原子的价层电子排布式为3s23p5
B.稳定性:Y的氢化物>Z的氢化物
C.第一电离能:Y<Z
D.X、Y两元素形成的化合物为离子化合物
难度: 中等查看答案及解析
-
下列叙述错误的是( )
①离子键没有方向性和饱和性,而共价键有方向性和饱和性
②配位键在形成时,是由成键双方各提供一个电子形成共用电子对
③金属键的实质是金属中的“自由电子”与金属阳离子形成的一种强烈的相互作用
④在冰晶体中,既有极性键、非极性键,又有氢键
⑤化合物NH4Cl和CuSO4·5H2O都存在配位键
⑥NaCl、HF、CH3CH2OH、SO2都易溶于水,但原因不完全相同( )
A.①③ B.②④ C.②⑤ D.④⑥
难度: 简单查看答案及解析
-
下列各组表述中,两个微粒一定不属于同种元素原子的是( )
A.3p能级有一个空轨道的基态原子和核外电子排布为1s22s22p63s23p2的原子
B.M层全充满而N层为4s2的原子和核外电子排布为1s22s22p63s23p63d64s2的原子
C.最外层电子数是核外电子总数的
的原子和价电子排布为4s24p5的原子
D.2p能级有一个未成对电子的基态原子和价电子排布为2s22p5的原子
难度: 简单查看答案及解析
-
下列有关电子排布图的表述正确的是
A.
 可表示单核10电子粒子基态时电子排布
可表示单核10电子粒子基态时电子排布B.
 此图错误,违背了泡利原理
此图错误,违背了泡利原理C.
表示基态N原子的价电子排布
D.
 表示处于激发态的B原子的核外电子排布图
表示处于激发态的B原子的核外电子排布图难度: 中等查看答案及解析
-
下表列出了某短周期元素R的各级电离能数据(用I1、I2……表示,单位为kJ·mol-1)。关于元素R的判断中一定正确的是( )
I1
I2
I3
I4
……
R
740
1 500
7 700
10 500
①R的最高正价为+3价 ②R元素位于元素周期表中第ⅡA族 ③R元素第一电离能大于同周期相邻元素 ④R元素基态原子的电子排布式为1s22s2
A. ①② B. ②③ C. ③④ D. ①④
难度: 中等查看答案及解析
-
下列说法中不正确的是
A.N2O与CO2、CCl3F与CCl2F2互为等电子体
B.CCl2F2无同分异构体,说明碳原子采用sp3杂化
C.同种元素的含氧酸,该元素的化合价越高,含氧酸的酸性就越强,氧化性越强
D.由第ⅠA族和第ⅥA族元素形成的原子个数比为2∶1、电子总数为30的化合物,是离子化合物
难度: 中等查看答案及解析
-
以下有关元素性质的说法不正确的是
A.具有下列电子排布式的原子中:①1s22s22p63s23p2,②1s22s22p3,③1s22s22p2,④1s22s22p63s23p4,原子半径最大的是①
B.具有下列价电子排布式的原子中:①3s23p1,②3s23p2,③3s23p3,④3s23p4,第一电离能最大的是③
C.①Na、K、Rb,②N、P、As,③O、S、Se,④Na、P、Cl中,元素的电负性随原子序数增大而递增的是④
D.电子构型为[Xe]4f145d76s2的元素位于周期表中的f区
难度: 中等查看答案及解析
-
配位数为6的Co3+的配合物CoClm·nNH3,若1mol配合物与过量AgNO3作用生成1molAgCl沉淀,则m、n的值是
A.m=1,n=5 B.m=3,n=4
C.m=5,n=1 D.m=4,n=5
难度: 简单查看答案及解析
-
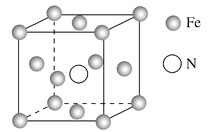
冰晶胞中水分子的空间排列方式与金刚石晶胞(其晶胞结构如图,其中空心球所示原子位于立方体的顶点及面心,实心球所示原子位于立方体内)类似。有关冰晶胞的说法合理的是
A.冰晶胞内水分子间以共价键相结合
B.晶体冰与金刚石晶体硬度都很大
C.冰分子间的氢键具有方向性和饱和性,也是一种σ键
D.氢键的存在导致冰晶胞与金刚石晶胞微粒的排列方式类似
难度: 中等查看答案及解析
-
下列叙述正确的是
A.分子的中心原子通过sp3杂化轨道成键时,该分子一定为正四面体结构
B.1,2-二氯丙烷(
)分子中含有两个手性碳原子
C.熔、沸点:Na<Mg<Al
D.配合物的稳定性与配位键的强弱有关,与配位体的性质无关
难度: 中等查看答案及解析
-
下列对一些实验事实的理论解释正确的是
选项
实验事实
理论解释
A
SO2溶于水形成的溶液能导电
SO2是电解质
B
白磷为正四面体结构的分子
白磷分子中P—P键间的键角是109.5°
C
1体积水可以溶解约700体积氨气
氨是极性分子且存在氢键的影响
D
HF的沸点高于HCl
H—F的键长比H—Cl的键长短
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
五种前四周期元素X、Y、Z、W、R在元素周期表中的位置如图所示.下列有关元素的叙述中,正确的是( )
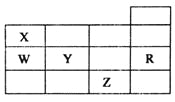
A.W的简单氢化物的沸点比X的简单氢化物的沸点低
B.五种元素均在元素周期表的s区
C.电负性和第一电离能均为:Y>X>W
D.五种元素的单质所形成的晶体类型不相同
难度: 中等查看答案及解析
-
已知H2O2分子的空间结构可在二面角中如图所示,下列有关H2O2结构的说法正确的是( )
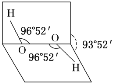
A. H2O2中有3个σ键、1个π键
B. H2O2为非极性分子
C. H2O2中氧原子为sp杂化
D. H2O2沸点高达158 ℃,可推测H2O2分子间可形成氢键
难度: 中等查看答案及解析
-
下列说法不正确的是
A. NH4+与H3O+中心原子的价层电子对数相同
B.BF3中硼原子的杂化类型与苯中碳原子的杂化类型相同
C.SO2和O3互为等电子体,但两者具有不同的化学性质
D. ClO2−、ClO3−、ClO4−中的氯原子都采取sp3杂化,离子中相邻两个Cl−O键间键角依次减小
难度: 中等查看答案及解析
-
下列说法中错误的是
A.从CH4、NH4+、SO42-为正四面体结构,可推测PH4+、PO43-也为正四面体结构
B.1mol金刚石晶体中,平均含有2molC—C键
C.构成单质分子的微粒之间不一定存在共价键
D.某气态团簇分子结构如图所示,该分子的分子式为EF或FE

难度: 中等查看答案及解析
-
氰气化学式为(CN)2,结构式为 N≡C—C≡N,性质与卤素相似,叙述正确的是( )
A.在一定条件下可发生加成反应
B.分子中N≡C键的键长大于C—C键的键长
C.分子中含有2个σ键和4个π键
D.不能与氢氧化钠溶液发生反应
难度: 中等查看答案及解析
-
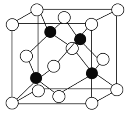
报道称某种合金材料有较大的储氢容量,其晶体结构的最小单元如图。则这种合金的化学式为
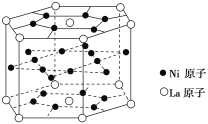
A.LaNi3 B.LaNi4
C.LaNi5 D.LaNi6
难度: 简单查看答案及解析
-
晶胞是构成晶体的基本重复单元.在二氧化硅晶胞中有8个硅原子位于立方晶胞的8个顶角,有6个硅原子位于晶胞的6个面心,还有4个硅原子与16个氧原子在晶胞内构成4个硅氧四面体,它们均匀错开排列于晶胞内.根据图示二氧化硅晶胞结构,每个晶胞内所含“SiO2”基元数为( )
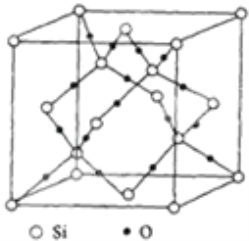
A.4个
B.6个
C.8个
D.18个
难度: 中等查看答案及解析
-
下列说法中正确的是
A.卤化氢中,HF沸点最高,是由于HF分子间存在氢键
B.邻羟基苯甲醛的熔、沸点比对羟基苯甲醛的熔、沸点高
C.H2O比H2S稳定,是与H2O分子间氢键有关的
D.氢键X—H…Y的三个原子总在一条直线上
难度: 中等查看答案及解析
-
经X射线研究证明:PCl5在固体状态时,由空间构型分别是正四面体和正八面体两种离子构成,下列关于PCl5的推断正确的是( )
A.PCl5固体是分子晶体
B.PCl5晶体具有良好的导电性
C.PCl5晶体有[PCl4]+和[PCl6]-构成,其离子数目之比为1∶1
D.PCl5晶体有[PCl3]2+和[PCl7]2-构成,其离子数目之比为1∶1
难度: 中等查看答案及解析
-
镍能形成多种不同的化合物。图1是镍的一种配合物的结构,图2是一种镍的氧化物的晶胞。判断下列说法正确的是
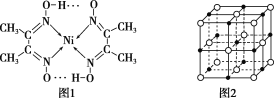
A.图2可能表示的是NiO的晶胞
B.图1中C、N、O的第一电离能C>N>O
C.图2中离镍原子最近的镍原子数共为8个
D.图1分子中存在的化学键有共价键、配位键、氢键
难度: 中等查看答案及解析