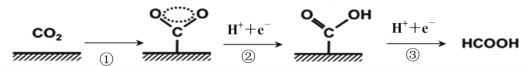
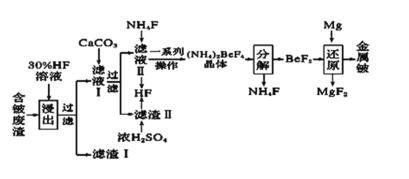
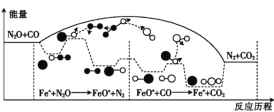
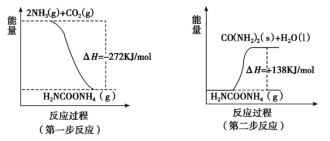
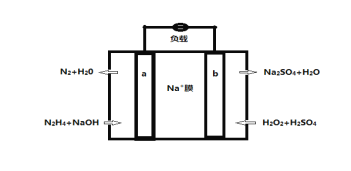
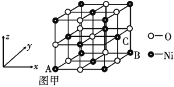
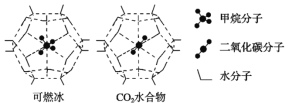
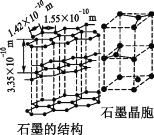
-
化学与人类生产、生活、社会可持续发展密切相关,下列说法正确的是
A.医用酒精的浓度为 95%,此浓度杀灭新冠病毒效果最好
B.SO2排放会导致的环境污染是酸雨
C.牛大棒骨属于厨余垃圾(湿垃圾)
D.“水滴石穿、水乳交融”都不涉及化学变化
难度: 简单查看答案及解析
-
下列有关原子、分子或物质所对应的表示式正确的是
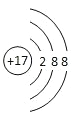
A.氯原子结构示意图:
 B.氯化钠电子式:
B.氯化钠电子式:C.水分子结构式:
D.乙炔分子比例模型:

难度: 中等查看答案及解析
-
第26届国际计量大会修订了阿伏加德罗常数的定义,并于2019年5月20日正式生效。NA表示阿伏加德罗常数的值,下列说法正确的是
A.常温常压下,11.2 L Cl2含氯原子数为NA
B.0.05 mol
原子中含中子数目为13.3NA
C.l mol FeI2与少量氯气反应时转移的电子数为 2NA
D.常温下,28 g乙烯中含有的碳原子数为2NA
难度: 简单查看答案及解析
-
中国工程院院士、国家卫健委高级别专家组成员李兰娟团队,于2月4日公布阿比朵尔、达芦那韦可抑制新型病毒。如图所示有机物是合成阿比朵尔的原料,关于该有机物下列说法正确的是
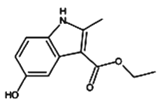
A.分子式为C12H14NO3
B.易溶于水和有机溶剂
C.分子结构中含有三种含氧官能团
D.可以发生加成反应、取代反应、水解反应和氧化反应
难度: 简单查看答案及解析
-
水溶液中能大量共存的一组离子是
A.K+、Na+、
、
B.Cl-、
、Fe2+、H+
C.
、Ba2+、Br-、
D.Na+、H+、
、
难度: 简单查看答案及解析
-
下列说法正确的是
A.25℃时,将pH=a的一元强酸溶液与pH=14﹣a的一元碱溶液等体积混合后,所得溶液呈酸性或中性
B.向醋酸钠溶液中加盐酸至溶液呈中性,则c(Clˉ)=c(CH3COOH)
C.常温下,已知CH3COOH的电离平衡常数为Ka、CH3COONa的水解平衡常数为Kh、则Ka·Kw=Kh
D.向NH4HSO4溶液中滴加NaOH溶液至中性,所得混合液中c(Na+)>c(
)>c(
)>c(OH-)=c(H+)
难度: 中等查看答案及解析