-
下列变化属于物理变化的是( )
A.煤的气化 B.石油的分馏 C.煤的干馏 D.乙烯聚合
难度: 中等查看答案及解析
-
下列叙述正确的是 ( )
A.O2分子间存在着非极性共价键 B.CO2分子内存在着极性共价键
C.SO2与H2O反应的产物是离子化合物 D.盐酸中含有H+和Cl-,故HCl为离子化合物
难度: 简单查看答案及解析
-
把A、B、C、D四块金属泡在稀H2SO4中,用导线两两相连可以组成各种原电池。若A、B相连时,A为负极;C、D相连,D上有气泡逸出;A、C相连时A极减轻;B、D相连,B为正极。则四种金属的活泼性顺序由大到小排列为
A. A>C>D>B B. A>C>B>D C. B>D>C>A D. A>B>C>D
难度: 中等查看答案及解析
-
下列金属的冶炼方法正确的是( )
A.电解氯化钠溶液冶炼金属钠
B.电解熔融的氯化铝冶炼金属铝
C.将铁粉与氧化镁混合加热冶炼镁
D.用一氧化碳还原氧化铁冶炼铁
难度: 中等查看答案及解析
-
借助碱金属和卤族元素性质的递变性分析下面的推断,其中正确的是( )
A.已知Ca是第四周期第ⅡA族元素,故Ca(OH)2的碱性比Mg(OH)2的碱性弱
B.已知As是第四周期第ⅤA族元素,故AsH3的稳定性比NH3的稳定性强
C.已知Cs的原子半径比Na的原子半径大,故Cs与水反应不如Na与水反应剧烈
D.已知Cl的核电荷数比F的核电荷数多,故Cl的原子半径比F的原子半径大
难度: 简单查看答案及解析
-
下列关于化学用语“NH4Cl”的意义,不正确的是( )
A. 氯化铵分子中含有一个NH4+和一个Cl-
B. 氯化铵由N、H、Cl三种元素组成
C. 氯化铵晶体由NH4+和Cl-构成
D. 氯化铵晶体中阴、阳离子个数比为1: 1
难度: 简单查看答案及解析
-
下列各组中属于同位素关系的是( )
A.金刚石与石墨 B.T2O与H2O C.40K与39K D.16O与16O2-
难度: 简单查看答案及解析
-
制取一氯乙烷的最佳方法是( )
A.乙烷和氯气反应
B.乙烯和氯气反应
C.乙烯和氯化氢反应
D.乙烯和氢气反应后,所得产物再和氯气反应
难度: 中等查看答案及解析
-
X、Y、Z均为元素周期表中前20号元素,Xa+、Yb-、Z(b+1)-简单离子的电子层结构相同,下列说法正确的是( )
A.已知mXa+与nYb-,得m+a=n-b
B.离子半径:Yb->Z(b+1)->Xa+
C.Z(b+1)-的还原性一定大于Yb-
D.气态氢化物的稳定性Hb+1Z一定大于HbY
难度: 中等查看答案及解析
-
化学科学需要借助化学专用语言描述,下列有关化学用语正确的是
A.CO2的电子式
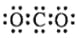 B.Cl-的结构示意图
B.Cl-的结构示意图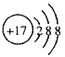
C.乙烯的结构简式 C2H4 D.质量数为37的氯原子
难度: 中等查看答案及解析
-
下列变化过程,属于放热反应的是( )
①水蒸气变成液态水 ②酸碱中和反应 ③浓硫酸稀释 ④碳与二氧化碳化合 ⑤H2在Cl2中燃烧 ⑥氯化钠电离
A.②③④⑤ B.②③④ C.②⑤ D.①③⑤
难度: 简单查看答案及解析
-
某元素R的阴离子R2-核外共有a个电子,核内有b个中子,则表示R原子组成符号正确的是( )
A.
R B.
R C.
R D.
R
难度: 简单查看答案及解析
-
已知2H2(g)+CO(g)
CH3OH(g)为放热反应,对该反应的下列说法正确的是( )
A.因该反应为放热反应,故不加热就可发生
B.相同条件下,2 mol H2的能量或1 mol CO 的能量一定高于1 mol CH3OH的能量
C.相同条件下,反应物2 mol H2和1 mol CO 的总能量一定高于生成物1 mol CH3OH(g)的总能量
D.达到平衡时,CO的浓度与CH3OH的浓度一定相等
难度: 简单查看答案及解析
-
反应A(g)+ 3B(g)
2C(g) + 2D(g)在四种不同情况下的反应速率分别为①v(A)= 0.15 mol/(L·s)②v(B)=0.6 mol/(L·s) ③v(C)=0.5 mol/(L·s)④v(D)=0.45 mol/(L·s)。下列表示该反应进行由快到慢的顺序正确的是( )
A.②③④① B.④③②① C.③④②① D.②④③①
难度: 简单查看答案及解析
-
下列各组中的性质比较正确的是( )
①酸性:HClO4>HBrO4>HIO4 ②碱性:KOH>Ca(OH)2>Mg(OH)2 ③稳定性:HCl>H2S>PH3 ④还原性:F->Cl->Br- ⑤熔点:Li<Na<K<Rb<Cs
A. ①③⑤ B. ②③④ C. ①②③ D. ③④⑤
难度: 中等查看答案及解析
-
某元素的一种同位素X 的质量数为A,含N个中子,它与1H 原子构成HmX分子。在agHmX中所含质子的物质的量是
A.
mol B.
(A-N)mol
C.
(A-N)mol D.
(A-N+m)mol
难度: 中等查看答案及解析
-
某可逆反应达到平衡状态时,下列说法不正确的是( )
A.化学平衡是一种动态平衡,v正=v逆≠0
B.一定条件下,可逆反应都能达到平衡状态
C.平衡状态时,反应混合物中各组分含量保持不变
D.平衡状态时,反应混合物中各物质的浓度一定相同
难度: 简单查看答案及解析
-
下列说法不正确的是 ( )
①质子数相同的粒子一定属于同种元素 ②同位素的物理性质有较大差别而化学性质几乎完全相同 ③元素种类由质子数决定,原子种类由质子数和中子数共同决定,元素主要化学性质由最外层电子数决定 ④电子数相同的粒子不一定是同一种元素 ⑤每种元素都有两种或两种以的核素
A.①②④⑤ B.③④⑤ C.②③⑤ D.①⑤
难度: 简单查看答案及解析
-
下列各组物质互为同分异构体的是( )
A. CH3—CH3和CH3—CH2—CH3
B. 12C和14C
C. CH3—CH2—CH2—CH3和(CH3)2CHCH3
D.
和
难度: 简单查看答案及解析
-
海水提镁的主要流程如下,下列说法正确的是( )
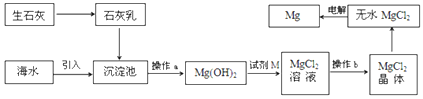
①试剂M是盐酸 ②流程中的反应全部都是非氧化还原反应
③操作b只是过滤 ④用海水晒盐后的饱和溶液加石灰乳制Mg(OH)2
⑤采用电解法冶炼镁是因为镁很活泼
A.①②③④⑤ B.②③ C.④⑤ D.①④⑤
难度: 中等查看答案及解析
-
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s),下列说法错误的是( )
A.电池工作时,锌失去电子
B.正极材料MnO2发生还原反应
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过0.2 mol电子,消耗锌6.5 g
难度: 简单查看答案及解析
-
下列各组物质之间的化学反应,反应产物一定为纯净物的是
A.
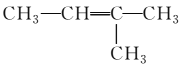 +Br2
+Br2B.CH2=CHCH2CH3+HCl
C.CH3CH=CH2+H2O

D.nCH2=CH2+nCH2=CHCH3
难度: 中等查看答案及解析