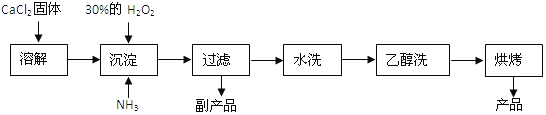
-
化学与科学、技术、社会、环境密切相关,下列说法正确的是( )
A.SiO2具有导电性,可用于制作光导纤维和光电池
B.煤经过气化和液化等物理变化可转化为清洁燃料
C.乙酰胺(
)与甘氨酸的化学性质相同
D.屠呦呦用乙醚从青蒿中提取出对治疗疟疾有特效的青蒿素,该过程包括萃取操作
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.根据分散系是否具有丁达尔效应将分散系分为溶液、胶体和浊液
B.核酸是一类含磷的生物高分子化合物,在稀盐酸中可发生水解
C.离子化合物NH5(H有正价和负价),阴离子为8电子稳定结构
D.常温下,35.5gCl2溶于水后,溶液中Cl2、HClO、ClO-、Cl-四种微粒总数为NA
难度: 简单查看答案及解析
-
下列离子方程式的书写正确的是( )
A.向Na2S2O3溶液中通入足量氯气:S2O
+4Cl2+5H2O=2SO
+8Cl-+10H+
B.向AlCl3溶液中加入足量氨水:Al3++4NH3·H2O=AlO
+4NH
+2H2O
C.向碳酸氢铵溶液中加入足量石灰水:Ca2++HCO
+OH-=CaCO3↓+H2O
D.在海带灰的浸出液(含有I-)中滴加H2O2得到I2:2I-+H2O2+2H+=I2+O2↑+2H2O
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A.熵增原理不可独立作为反应自发性的判据
B.生产普通玻璃的主要原料为石灰石、纯碱和石英砂
C.硫元素在自然界的存在形式有硫单质、硫化物和硫酸盐等
D.6.4gCu与3.2g硫粉混合隔绝空气加热,充分反应后,转移电子数为0.2NA
难度: 中等查看答案及解析
-
短周期主族元素W、X、Y、Z原子序数依次增大,其中只有X、Y处于同一周期,且相邻;Y是地壳中含量最多的元素;Z是短周期中金属性最强的元素。下列说法正确的是( )
A.离子半径:r(Z)<r(X)<r(Y)
B.X的单质的氧化性比Y的强
C.化合物Z2Y2中阴、阳离子个数比为1∶1
D.W、X、Y三种元素可以组成共价化合物和离子化合物
难度: 中等查看答案及解析
-
室温下,下列有关结论正确的是( )
A.向稀醋酸中加水稀释使电离程度增大,溶液pH减小
B.将CH3COONa溶液从20℃升温至30℃,
溶液中增大
C.向0.1mol·L-1的NaHSO3溶液中加入氨水至中性,则c(Na+)+c(NH
)=2c(SO
)+c(HSO
)
D.为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH。若pH<7,则H2A是强酸
难度: 困难查看答案及解析
-
下列实验中,能达到相应实验目的的是

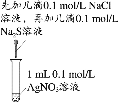
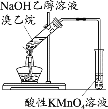
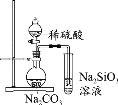
A.制备并收集乙酸乙酯
B.证明氯化银溶解度大于硫化银
C.验证溴乙烷的消去产物是乙烯
D.推断S、C、Si的非金属性强弱
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下面有关叙述中,不正确的是( )
A.CH4中心原子的杂化轨道类型为sp3杂化
B.以非极性键结合起来的双原子分子一定是非极性分子
C.氯化钠晶体中,Na+和Cl-的配位数均为8
D.镍元素基态原子的电子排布式为:1s22s22p63s23p63d84s2
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.除去NaHCO3固体中的Na2CO3固体可用加热的方法
B.工业上采取电解熔融氧化镁的方法炼制金属镁
C.重结晶法提纯有机物选择溶剂要求:杂质在溶剂中溶解度受温度影响较大
D.溴乙烷与NaOH溶液共热后,加入AgNO3溶液,未出现淡黄色沉淀,不能说明溴乙烷没有水解
难度: 中等查看答案及解析
-
卡拉诺利是一种抗HIV药物,其结构简式如图所示,下列关于卡拉诺利的说法正确的是( )
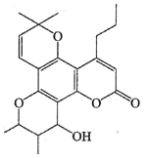
A.该物质遇FeCl3溶液显紫色
B.分子中有3种含氧官能团
C.该物质属于苯的同系物
D.1mol该物质与足量NaOH溶液反应时消耗1molNaOH
难度: 简单查看答案及解析
-
研究小组采用电解法(惰性电极)将含有Al(OH)3、MnO2和少量Na2CrO4的浆液分离成固体混合物和含铬元素的溶液,装置如图。下列说法不正确的是( )
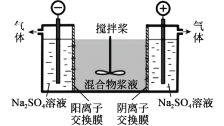
A.阳极的电极反应式为:2H2O-4e-=O2↑+4H+
B.适当增大电压,CrO
也可在阴极室转化为Cr(OH)3除去
C.阴极室生成的物质可用于固体混合物Al(OH)3和MnO2的分离
D.CrO
通过阴离子交换膜进入阳极室,从而实现与浆液的分离
难度: 中等查看答案及解析
-
在3个体积均为2.0 L的恒容密闭容器中,反应CO2(g)+C(s)
2CO(g)ΔH>0,分别在一定温度下达到化学平衡状态。下列说法正确的是
容器
温度/K
起始时物质的量/mol
平衡时物质的量/mol
n(CO2)
n(C)
n(CO)
n(CO)
I
977
0.28
0.56
0
0.4
II
977
0.56
0.56
0
x
III
1250
0
0
0.56
y
A.977K,该反应的化学平衡常数值为2
B.达到平衡时,向容器I中增加C的量,平衡正向移动
C.达到平衡时,容器Ⅰ中CO2的转化率比容器Ⅱ中的大
D.达到平衡时,容器Ⅲ中的CO的转化率大于28.6%
难度: 中等查看答案及解析


 的合成路线(部分反应条件略去)如图所示。
的合成路线(部分反应条件略去)如图所示。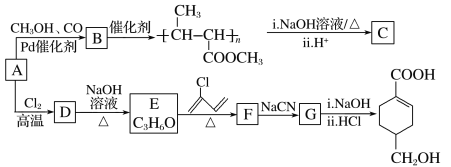
 ;R—C
;R—C 发生缩聚反应生成有机物的结构简式为___。
发生缩聚反应生成有机物的结构简式为___。 CH3COOCH2CH3。
CH3COOCH2CH3。