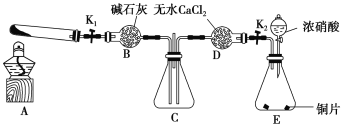
-
下列有关物质的性质与用途具有对应关系的是
A. SO2具有氧化性,可用于漂泊纸浆
B. NH4HCO3 受热易分解,可用作氮肥
C. 明矾溶于水产生的SO42- 有氧化性,可用于净水
D. 常温下铁能被浓硝酸钝化,可用铁质容器贮运浓硝酸
难度: 简单查看答案及解析
-
历史表明:没有新材料的出现,就没有科技和生产发展的突破。信息高速公路的建立在于寻找新的信息材料。下列材料可作信息材料的是( )
A. 铜线 B. 化纤 C. 橡胶 D. 光导纤维
难度: 简单查看答案及解析
-
下列我国古代优秀艺术作品中,所用材料不属于无机非金属材料的是( )
A.商代后母戊鼎

B.新石器时代人面鱼纹彩陶盆

C.明永乐青花竹石芭蕉纹梅瓶

D.三国青瓷羊形烛台
难度: 简单查看答案及解析
-
某元素B的核电荷数为Z,已知Bn-和Am+的核外具有相同的电子层结构,则A元素的原子序数用Z、n、m来表示,应为( )
A.Z+n-m B.Z-n+m C.Z-n-m D.Z+m+n
难度: 简单查看答案及解析
-
下列装置可以构成原电池的是
A.
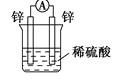 B.
B.
C.
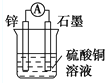 D.
D.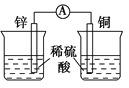
难度: 简单查看答案及解析
-
“摇摇冰”是一种即用即冷的饮料。吸食时将饮料罐隔离层中的化学物质和水混合后摇动即会制冷。该化学物质可能是( )
A.氯化钠 B.固体硝酸铵 C.生石灰 D.蔗糖
难度: 简单查看答案及解析
-
某元素X最高价含氧酸的相对分子质量为98,且X的氢化物的分子式不是H2X,则下列说法正确的是( )
A.X的最高价含氧酸的分子式可表示为H3XO4
B.X是第二周期VA族元素
C.X是第三周期ⅥA族元素
D.X的最高化合价为+4
难度: 简单查看答案及解析
-
下列说法正确的是
①正常雨水的pH为7.0,酸雨的pH小于7.0
②严格执行机动车尾气排放标准有利于防止大气污染
③使用二氧化硫和某些含硫化合物进行增白的食品会对人体健康产生损害
④使用氯气对自来水消毒过程中,生成的有机氯化物可能对人体有害
⑤食品厂产生的含丰富氮、磷营养元素的废水可长期排向水库养鱼
A. ①②③ B. ①④⑤ C. ②③④ D. ③④⑤
难度: 中等查看答案及解析
-
下列各图中,表示正反应是吸热反应的图是( )
A.
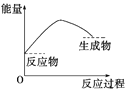 B.
B.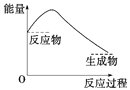
C.
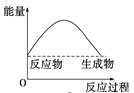 D.
D.
难度: 简单查看答案及解析
-
依据下列实验现象,所得结论不正确的是
实验
实验现象
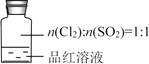
①品红溶液红色褪去,经检验溶液中含有SO42-
②加热褪色后的溶液至沸腾,未见颜色恢复,有气体溢出,可使蓝色石蕊试纸变红,遇淀粉碘化钾试纸,无明显变化。
A. 品红溶液褪色是氯水漂白所致
B. 集气瓶中发生了反应:Cl2 + SO2 + 2H2O H2SO4 + 2HCl
C. 依据现象②可确定产生的气体为SO2
D. 检验SO42-的试剂为:盐酸、BaCl2溶液
难度: 中等查看答案及解析
-
如图所示,硫酸工业中产生的SO2通过下列过程既能制得H2SO4又能制得H2。下列说法不正确的是
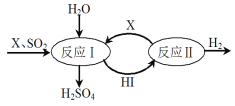
A. 该过程可循环利用的物质是I2和HI
B. 该过程总反应的化学方程式SO2 + 2H2O=H2SO4 + H2
C. X物质是I2
D. SO2 在过程中表现出了还原性与漂白性
难度: 中等查看答案及解析
-
将0.2mol MnO2和50mL 12mol·L-1盐酸混合后缓慢加热,反应完全后向留下的溶液中加入足量AgNO3溶液,生成AgCl沉淀,物质的量为x mol(不考虑盐酸的挥发),则x的取值范围是
A.x=0.3 B.x<0.3 C.0.3<x<0.6 D.以上结论都不对
难度: 中等查看答案及解析
-
短周期元素X、Y、Z在周期表中的位置如图所示,则下列说法正确的是
A. Z一定是活泼的金属
B. Y的最高价氧化物的水化物是一种强酸
C. Z的最高价氧化物的水化物是强酸
D. 1 molY单质跟足量水反应时,有1 mol电子发生转移
难度: 中等查看答案及解析
-
下列说法中正确的是
A.原子及其离子的核外电子层数等于该元素所在的周期数
B.元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素
C.稀有气体原子的最外层电子数都是8
D.同一元素的各种同位素的物理性质、化学性质均相同
难度: 简单查看答案及解析
-
有4种短周期元素W、X、Y、Z的原子序数依次增大,其原子的最外层电子数之和为19,W和X元素原子内质子数之比为1:2,X2+和Z-离子的电子数之差为8,下列说法不正确的是( )
A.与W相邻的同主族元素可制成重要的半导体材料
B.元素原子半径从大到小的顺序是X、Y、Z
C.W、Y、Z元素最高价氧化物对应的水化物中酸性最强的是H2YO4
D.WZ4分子中W、Z原子通过共价键结合且最外层均达到8电子结构
难度: 中等查看答案及解析
-
如图是某元素的价类二维图,其中A为正盐,X是一种强碱,通常条件下Z是无色液体,E的相对分子质量比D大16,各物质的转化关系如图所示。下列说法错误的是
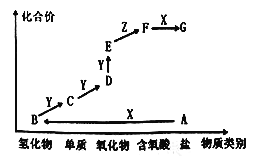
A.A作肥料时不适合与草木灰混合施用
B.同主族元素的氢化物中B的沸点最低
C.C一般用排水法收集
D.D→E的反应可用于检验D
难度: 中等查看答案及解析
-
微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法错误的是
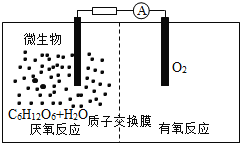
A.正极反应中有CO2生成
B.微生物促进了反应中电子的转移
C.质子通过交换膜从负极区移向正极区
D.电池总反应为C6H12O6+6O2=6CO2+6H2O
难度: 中等查看答案及解析
-
如图是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下:在卡片上,描述合理的是( )
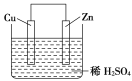
①Zn为正极,Cu为负极
②H+向正极移动
③电子流动方向,从Zn经外电路流向Cu
④Cu极上有H2产生
⑤若有1mol电子流过导线,则产生H2为0.5mol
⑥正极的电极反应式为:Zn-2e-=Zn2+
A.①②③⑤ B.②③④⑤ C.②④⑤⑥ D.①②③④
难度: 简单查看答案及解析
-
1.92g铜投入一定量的浓硝酸中,铜完全溶解,生成气体颜色越来越浅,共收集到672 mL气体(标准状况),将盛有此气体的容器倒扣在水中,通入氧气恰好使气体完全溶解在水中,则需要标准状况下的氧气体积为
A.504mL B.336 mL C.224 mL D.168mL
难度: 中等查看答案及解析