-
现有四组混合液:①汽油和氯化钠溶液 ②碳酸钙和碳酸钠溶液 ③氯化钠和单质碘的水溶液 ④40%的乙醇溶液,分离以上各混合液的正确方法依次是
A.分液、过滤、萃取、蒸馏 B.蒸馏、分液、萃取、过滤、
C.分液、蒸馏、过滤、萃取 D.蒸馏、过滤、分液、萃取
难度: 简单查看答案及解析
-
下列说法中,正确的是(NA代表阿伏伽德罗常数的值)
A.60g二氧化硅含有NA个二氧化硅分子
B.在标准状况下,22.4 LSO3的质量为80 g
C.46gNO2与N2O4混合气体中含有2NA个氧原子
D.67.2L 二氧化氮与水完全反应转移2NA个电子
难度: 简单查看答案及解析
-
用0.1 mol / L的Na2SO3溶液30 mL,恰好将2×10-3 mol的XO4-离子还原,则元素X在还原产物中的化合价是 ( )
A.+1 B.+2 C.+3 D.+4
难度: 中等查看答案及解析
-
下列实验设计及其对应的离子方程式均正确的是
A.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO
+ 6H+ + 5H2O2 = 2Mn2+ + 5O2↑ + 8H2O
B.Na2O2与H2O反应制备O2 :Na2O2 + H2O = 2Na+ + 2OH- + O2↑
C.将氯气溶于水制备次氯酸:Cl2 + H2O = 2H+ + Cl- + ClO-
D.用FeCl3溶液腐蚀铜线路板:Cu + 2Fe3+ = Cu2+ + 2Fe2+
难度: 中等查看答案及解析
-
在溶液中加入过量Na2O2后仍能大量共存的是
A.NH
、Ba2+、Cl-、NO
B.K+、SiO
、AlO
、SO
C.Fe2+、Mg2+、SCN-、Cl- D.Na+、SO
、I-、HCO
难度: 中等查看答案及解析
-
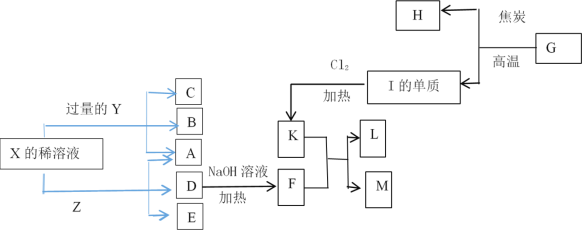
下列说法正确的是
①硅是一种良好的半导体材料,是光导纤维的基本材料
②NH3极易溶于水,因此可用作制冷剂
③豆科植物根瘤菌可以实现氮的固定
④铁路建设所需的大量水泥属于新型无机非金属材料
⑤在含硫的燃料中加入适量生石灰,以减少二氧化硫的排放量
⑥ClO2具有还原性,因此可用于自来水的杀菌消毒
⑦Na2O2吸收CO2产生O2,可用作呼吸面具供氧剂
⑧婺州窑胎体的原料为高岭土[Al2Si2O5(OH)4],用氧化物形式表示为:Al2O3•2SiO2•2H2O
A.②③⑤⑦ B.③⑤⑦⑧ C.①③⑦⑧ D.③④⑤⑧
难度: 中等查看答案及解析
-
已知常温下KClO3与浓盐酸反应放出氯气,现按下图进行卤素的性质实验。玻璃管内装有分别滴有不同溶液的白色棉球,反应一段时间,对图中各部位颜色描述正确的是
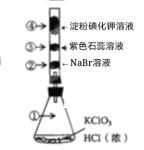
选项
①
②
③
④
A
黄绿色
橙色
白色
蓝色
B
无色
橙色
白色
紫色
C
黄绿色
橙色
无色
蓝色
D
黄绿色
无色
无色
紫色
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
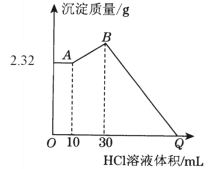
将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有3种含氯元素的离子,其中ClO-和ClO
两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示。下列说法正确的是
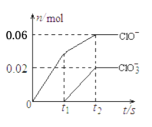
A.苛性钾中KOH的物质的量为0.24mol
B.反应中转移电子的物质的量是0.21mol
C.有2.688L氯气参与反应
D.酸性条件下ClO-和ClO
可生成Cl2
难度: 困难查看答案及解析
-
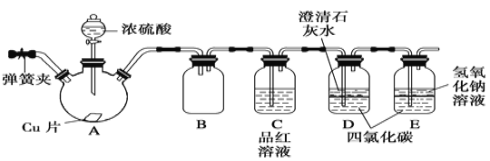
如图装置可用于收集SO2并验证其某些化学性质,下列说法正确的是
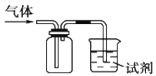
选项
试剂
现象
结论
A
酸性高锰酸钾溶液
溶液褪色
SO2有漂白性
B
品红溶液
溶液褪色
SO2有氧化性
C
滴有酚酞的NaOH溶液
溶液褪色
SO2有还原性
D
H2S水溶液
溶液变浑浊
SO2有氧化性
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
某集气瓶内装有红棕色混合气体,加入足量蒸馏水,盖上玻璃片振荡得橙黄色溶液,气体颜色消失,再打开玻璃片后,瓶中气体又变为红棕色,该混合气体可能是
A.N2、O2、Br2 B.NO2、Br2、O2 C.NO2、NO、N2 D.NO2、NO、O2
难度: 困难查看答案及解析
-
如图所示,当向集气瓶内通入17.5mLO2时,最后试管中液面仍在原来的位置,则原试管中NO的体积为
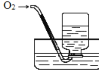
A.10mL B.12mL C.14mL D.8mL
难度: 困难查看答案及解析
-
如图,干燥烧瓶中盛满某种气体,烧杯和滴管内盛放某种溶液。挤压滴管的胶头,下列与实验事实相符的是
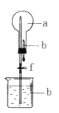
A.若a为Cl2,b为滴有酚酞的NaOH溶液,可出现红色喷泉
B.若a为CO2,b为NaHCO3溶液,可出现无色喷泉
C.若a为HCl,b为AgNO3溶液,可出现白色喷泉
D.若a为NH3,b为水(预先滴加少量石蕊溶液),可出现红色喷泉
难度: 简单查看答案及解析
-
下列关于元素周期表的说法正确的是
A.元素周期表是按照元素相对原子质量大小排列而成的
B.元素周期表有7个横行,也是7个周期;有18个纵行,即18个族
C.凡是位于元素周期表中同一周期的元素,都是按从左到右的顺序原子最外层电子数由1递增到8
D.凡是位于元素周期表中同一主族的元素,都是按从上到下的顺序电子层数逐渐增多
难度: 简单查看答案及解析
-
如图表示碱金属元素的某些性质与核电荷数的变化关系,下列各性质中不符合图示关系的是
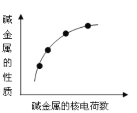
A.金属性
B.对应氢氧化物的碱性
C.原子半径
D.阳离子的氧化性
难度: 简单查看答案及解析
-
将一定量的铜粉加入到100 mL某浓度的稀硝酸中充分反应后,容器中剩有m1 g铜粉,此时共收集到NO气体224 mL(标准状况),然后向上述混合物中加入足量稀硫酸至不再反应为止,容器剩有铜粉m2 g, 则(m1-m2)为
A.5.76 B.2.88 C.1.92 D.0.28
难度: 中等查看答案及解析