-
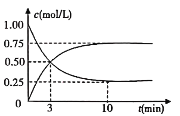
下列各组反应(表内物质均为反应物)刚开始时,放出H2的速率最大的是
编号
金属(粉末状)
酸的浓度
酸的体积
反应温度
A
0.1mol Mg
6mol/L硝酸
10mL
30℃
B
0.1mol Mg
3mol/L盐酸
10mL
60℃
C
0.1mol Fe
3mol/L盐酸
10mL
60℃
D
0.1mol Mg
3mol/L盐酸
10mL
30℃
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
古代染坊常用某种“碱剂”精炼丝绸,该“碱剂”的主要成分是一种盐,能促进蚕丝表层胶蛋白杂质水解而除去,使丝绸洁白、质感柔软、色泽光亮。这种“碱剂”可能是
A.食盐 B.熟石灰 C.明矾 D.草木灰
难度: 简单查看答案及解析
-
下列关于元素周期表的说法正确的是
A.能生成碱的金属元素都在ⅠA族
B.原子序数为114的元素位于元素周期表的第七周期ⅣA族
C.稀有气体元素原子的最外层电子数均为8
D.第ⅥA族元素的最高正价与最低负价的代数和为4
难度: 简单查看答案及解析
-
下列变化过程中,属于放热反应的是
①碳和二氧化碳 ②黑火药爆炸 ③固体NaOH溶于水 ④钠与水反应 ⑤铝热反应 ⑥NH4Cl晶体与Ba(OH)2•8H2O混合搅拌
A.①③⑥ B.②④⑤ C.②③④ D.②④⑥
难度: 简单查看答案及解析
-
下列化学用语表示正确的是
A.氢氧根离子式:
B.甲烷的球棍模型:
C.氯离子结构示意图:
 D.乙烯的结构简式:CH2CH2
D.乙烯的结构简式:CH2CH2难度: 简单查看答案及解析
-
下列化合物中只含共价键的是
A.KCl B.NaOH C.H2O D.MgCl2
难度: 简单查看答案及解析
-
根据元素周期律,由下列事实进行归纳推测,下列不合理的是
选项
事实
推测
A
Li与水能反应,Na与水反应剧烈
Rb与水反应更剧烈
B
Si是半导体材料,同族的Ge也是半导体材料
第ⅣA族的元素的单质都可以作半导体材料
C
HCl在1500℃时分解,HI在230℃时分解
HBr的分解温度介于二者之间
D
Si与H2高温时反应,S与H2加热能反应
P与H2在高温时能反应
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
联合国宣布2019年为“国际化学元素周期表年”,我国的刘庄教授为汞元素的代言人。下列关于
Hg的说法中,正确的是
A.质量数为278 B.中子数为118
C.质子数为198 D.中子数与核外电子数之差为80
难度: 简单查看答案及解析
-
下图是课外活动小组设计的用化学电源使LED灯发光的装置。下列说法正确的是

A. 溶液中的SO42-向铜极移动
B. 锌片为原电池的负极,发生还原反应
C. 如果将稀硫酸换成柠檬汁,导线中不会有电子流动
D. 铜片表面有气泡生成,发生的反应为:2H++2e-=H2↑
难度: 中等查看答案及解析
-
某有机物的结构简式如图所示,下列说法中错误的是

A.可用酸性KMnO4溶液检验其中的羟基
B.该有机物能与NaHCO3溶液反应放出CO2
C.该有机物能够在催化剂作用下发生加成反应
D.2mol该有机物和过量的金属钠反应最多可以生成3mol H2
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列有关叙述正确的是
A.0.1mol苯中含有的碳碳双键数为0.3NA
B.1molNO2与足量H2O反应,转移的电子数为NA
C.标准状况下,11.2L CO和CO2混合物含有碳原子数为0.5NA
D.密闭容器中,1 molN2与4molH2充分反应生成的NH3分子数为2NA
难度: 中等查看答案及解析
-
在能使石蕊溶液显红色的溶液中,一定能大量共存的离子组是
A.Na+、K+、Cl-、
B.
、Na+、S2-、
、
C.Ca2+、Fe2+、
、OH- D.Ca2+、
、
、
难度: 中等查看答案及解析
-
将一定量纯净的氨基甲酸铵置于密闭真空恒容容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)⇌2NH3(g)+CO2(g)。判断该分解反应已经达到化学平衡的是
A.密闭容器中c(NH3)∶c(CO2)=2∶1 B.2v(NH3)=v(CO2)
C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变
难度: 中等查看答案及解析
-
除去括号内杂质所用试剂和方法正确的是
A.乙醇(乙酸):加入氢氧化钠溶液后分液
B.乙烷(乙烯):通入酸性高锰酸钾溶液中洗气
C.乙酸乙酯(乙酸):滴入饱和碳酸钠溶液后蒸馏
D.乙醇(水):加入生石灰后蒸馏
难度: 简单查看答案及解析
-
X、Y、Z、W是短周期主族元素,X元素的单质在工业上通过分离液态空气得到;Y元素最高正价和最低负价的绝对值相等;Z元素+2价阳离子的核外电子排布与氖原子相同;W元素的最高价含氧酸是无机酸中酸性最强的。下列有关这些元素性质的说法一定正确的是
A.X元素的氢化物的水溶液显碱性
B.Z元素的离子半径大于W元素的离子半径
C.Z元素的单质在一定条件下能与X元素的单质反应
D.Y元素最高价氧化物具有很高的熔点和沸点
难度: 中等查看答案及解析
-
人们发现氧化铁硫杆菌能促使黄铁矿(FeS2)氧化成硫酸铁和硫酸,氧化铁硫杆菌能把矿物中的硫或硫化物氧化成硫酸,而硫酸和硫酸铁能将某些矿石中的金属元素转化成金属硫酸盐,从而开辟了“细菌冶金”的先河。氧化铁硫杆菌的活动过程如图所示,其中a过程发生的反应为4FeS2+15O2+2H2O
2Fe2(SO4)3+2H2SO4。则下列说法错误的是
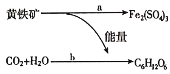
A.a过程中释放能量
B.细菌在反应a过程中起了催化剂的作用
C.b过程类似于植物的光合作用,细菌将能量储存在C6H12O6中
D.有些细菌可直接把含铅、汞等重金属的矿石溶解,得到重金属离子的溶液
难度: 中等查看答案及解析
 与
与 ; G.H2O与D2O; H.葡萄糖与果糖; I.蔗糖与麦芽糖
; G.H2O与D2O; H.葡萄糖与果糖; I.蔗糖与麦芽糖