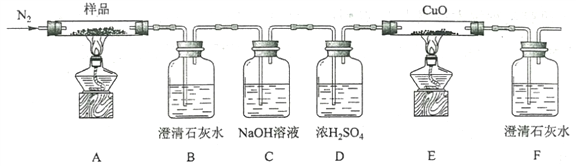
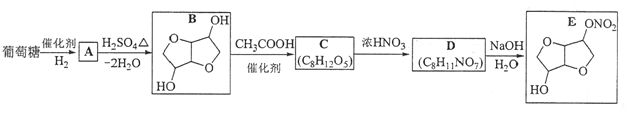
-
下列实验操作能达到实验目的的是
实验目的
实验操作
A
制备Fe(OH)3胶体
将NaOH浓溶液滴加到饱和的FeCl3溶液中
B
由MgCl2溶液制备无水MgCl2
将MgCl2溶液加热蒸干
C
除去Cu粉中混有的CuO
加入稀硝酸溶液,过滤、洗涤、干燥
D
比较水和乙醇中氢的活泼性
分别将少量钠投入到盛有水和乙醇的烧杯中
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
化学与生活密切相关。下列说法错误的是
A.泡沫灭火器可用于一般的灭火,也适用于电器灭火
B.疫苗一般应冷藏存放,以避免蛋白质变性
C.家庭装修时用水性漆替代传统的油性漆,有利于健康及环境
D.电热水器用镁棒防止内胆腐蚀,原理是牺牲阳极的阴极保护法
难度: 简单查看答案及解析
-
某电动汽车配载一种可充放电的锂离子电池。放电时电池的总反应为:Li1-xCoO2+LixC6=LiCoO2+ C6(x<1)。下列关于该电池的说法不正确的是( )
A.放电时,Li+在电解质中由负极向正极迁移
B.放电时,负极的电极反应式为LixC6-xe-= xLi++ C6
C.充电时,若转移1mole-,石墨C6电极将增重7xg
D.充电时,阳极的电极反应式为LiCoO2-xe-=Li1-xCoO2+Li+
难度: 中等查看答案及解析
-
NA为阿伏加德罗常数的值。下列说法正确的是
A.18 g D2O和18 g H2O中含有的质子数均为10NA
B.2 L 0.5 mol·L-1亚硫酸溶液中含有的H+离子数为2NA
C.过氧化钠与水反应时,生成0.1 mol氧气转移的电子数为0.2NA
D.密闭容器中2 mol NO与1 mol O2充分反应,产物的分子数为2NA
难度: 中等查看答案及解析
-
已知:C(s)+H2O(g)=CO(g)+H2(g) ΔH=a kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH=-220 kJ·mol-1
H—H、O=O和O—H键的键能分别为436kJ·mol-1、496kJ·mol-1和462 kJ·mol-1,则a为( )
A.-332 B.-118 C.+130 D.+350
难度: 简单查看答案及解析
-
短周期元素W、X、Y、Z的原子序数依次增大,分别可以形成简单离子W2-、X+、Y3+、Z2-,下列判断错误的是
A.W 和 Z 在同一主族
B.Y3+、 Z2-两种离子都能促进水的电离
C.X 元素的单质能跟水剧烈反应
D.W 元素能形成两种氢化物,分子中含有类型完全相同的化学键
难度: 中等查看答案及解析
-
NaOH溶液滴定邻苯二甲酸氢钾(邻苯二甲酸H2A的Ka1=1.1×10−3 ,Ka2=3.9×10−6)溶液,混合溶液的相对导电能力变化曲线如图所示,其中b点为反应终点。下列叙述错误的是( )
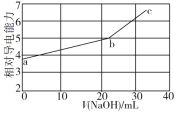
A.混合溶液的导电能力与离子浓度和种类有关
B.b点的混合溶液pH=7
C.Na+与A2−的导电能力之和大于HA−的
D.c点的混合溶液中,c(Na+)>c(K+)>c(OH−)
难度: 中等查看答案及解析