-
中国古代“炼丹术”中蕴含了丰富的化学知识,为近代化学的建立和发展奠定了基础。下列关于“炼丹术”中涉及的史实解释错误的是
选项
史 实
解 释
A
“胡粉[(PbCO3∙Pb(OH2) ]投火中,色坏还为铅(Pb)”
复分解反应原理
B
“有硇水者,剪银塊(Ag) 投之,则旋而为水”
氧化还原反应原理
C.
“曾青(硫酸铜)涂铁,铁赤色如铜……外变而内不化也”
置换反应原理
D
“铁釜代替土釜,加热丹砂(HgS),可增采也”
平衡移动原理
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
NA为阿伏加德罗常数的值。下列说法正确的是
A.13 g13 C含有的中子数目为6 NA
B.常温下 ,I LpH =4的醋酸溶液所含离子总数为2 ×10-4NA
C.100 g质量分数为 98% 的磷酸中所含氧原子总数为4 NA
D.0.1 mol Fe 完全溶于稀硝酸,转移的电子数目为0.3 NA
难度: 简单查看答案及解析
-
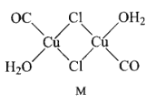
螺环化合物M(
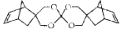 )是合成某功能材料的单体,下列关于M的说法错误的是
)是合成某功能材料的单体,下列关于M的说法错误的是A.分子式为C19H24O4 B.能发生加成反应、取代反应和氧化反应
C.一氯代物有 7 种(不含立体异构) D.所有氧原子可能处于同一平面上
难度: 简单查看答案及解析
-
蔥醌(AQDS)是一种具有氧化还原活性的廉价有机分子,蔥醌/碘化铵液流可充电电池(如图)以其环保、价廉、稳定等优点被研究及广泛应用。充电时,AQDS转化为AQDS (NH4)2。 下列说法错误的是
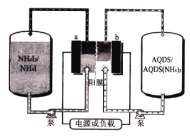
A.放电时 ,b极电势低于a极
B.充电时,a极的电极反应式为:3I--2e-= I3-
C.充电时,电路中每转移1 mole-, 膜两侧电解液的质量变化差为36 g
D.该装置中的阳膜也可以用阴膜代替
难度: 中等查看答案及解析
-
实验小组同学探究NH3与Cl2的反应,装置如图所示。常温常压下,将氨气收集在薄膜保鲜袋(无弹性)中,氯气收集在反应管中,关闭K,按图连接好装置;将氨气压入反应管,充分反应后打开K。下列说法错误的是

A.反应开始后,保鲜袋逐渐被吸入反应管
B.反应过程中,反应管中产生白烟
C.打开K后,水会倒吸入反应管
D.上述反应原理可用于检验输送氯气的管道是否泄漏
难度: 中等查看答案及解析
-
化合物甲是一种重要的医药中间体,其结构式如图所示。其中Q、W、X、Y、Z为原子半径依次递增的短周期元素,Q、X、Z分列于三个不同周期。下列说法错误的是
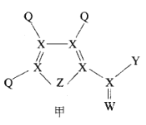
A.非金属性:X<Z<W
B.Q与W形成化合物的沸点高于Q与X形成化合物的沸点
C.化合物甲中除Q外,其它原子均满足8电子稳定结构
D.0.1 mol•L-1 最高价氧化物对应水化物的酸性:Y> Z
难度: 中等查看答案及解析
-
常温下,用 NaOH溶液滴定NH4HSO4溶液 ,混合溶液的相对导电能力变化曲线如图所示,已知: Kb(NH3• H2O) =10-5,下列叙述正确的是
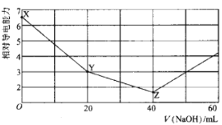
A.X→Y 过程中发生反应的离子方程式为:
+OH-= NH3• H2O
B.Y点满足:c(
) +c(Na+) =2c(
)
C.水的电离程度:X>Y>Z
D.若Z点溶液pH=1l,则此时溶液中氨水浓度约为0.1 mol•L-1
难度: 困难查看答案及解析
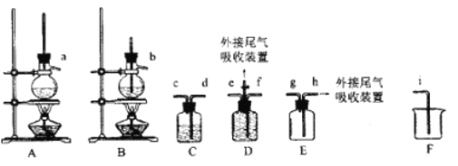
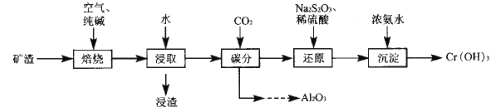
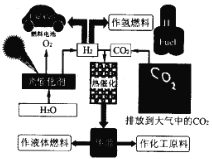
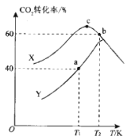
 ) 可用于鉴别 Cu2+。红氨酸分子中C 原子的价层电子对数目为___; N原子的杂化方式为___; N原子与 H原子形成共价键的电子云对称形式为___ 。
) 可用于鉴别 Cu2+。红氨酸分子中C 原子的价层电子对数目为___; N原子的杂化方式为___; N原子与 H原子形成共价键的电子云对称形式为___ 。