-
青铜是人类历史上一项重大发明,它是铜(Cu)、锡(Sn) 和铅(Pb) 的合金,也是金属冶铸史上最早的合金 。 请回答 :
(1)基态Cu原子通过失去_____轨道电子转化为Cu+;Sn的原子序数为50,基态Sn原子的价层电子排布式为______。
(2)红氨酸( ) 可用于鉴别 Cu2+。红氨酸分子中C 原子的价层电子对数目为___; N原子的杂化方式为___; N原子与 H原子形成共价键的电子云对称形式为___ 。
) 可用于鉴别 Cu2+。红氨酸分子中C 原子的价层电子对数目为___; N原子的杂化方式为___; N原子与 H原子形成共价键的电子云对称形式为___ 。
(3)CuCl的盐酸溶液能吸收CO, 该反应可用于测定气体混合物中CO的含量,生成物M的结构如下图所示。
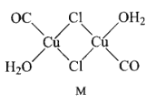
①与CO互为等电子体的离子为 _________(任写一种即可)。
②M中所有元素的电负性由大到小的顺序为 ____________。
③画图表示出M 中Cu原子形成的所有配位键_________。
(4)金属钙和铜的晶体结构相似,但铜的熔点比钙高,试分析其原因为___________。
(5)铜晶体中,Cu 原子之间会形成不同类型的空隙,比如下图铜晶胞中铜原子a1、a2、a3、a4 围成一个正四面体空隙 ,a2、a3、a4 、a5、a6、a7 围成一个正八面体空隙。
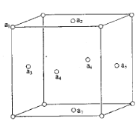
①铜晶体中,铜原子数:正四面体空隙数:正八面体空隙数=____。
②若a2 与a3 的核间距离为d pm, 阿伏加德罗常数的值为NA,则铜晶体的密度为___g•cm-3( 列出计算表达式)。
-
铜是人类最早使用的金属之一,其单质及化合物具有广泛的用途。
(1)基态铜原子核外有________对自旋相反的电子。
(2)青铜是铜与锡或铅等元素按一定比例熔铸而成的合金。第一电离能I1(Sn)____________I1(Pb)(填“大于”或“小于”)。
(3)新制的Cu(OH)2能够溶解于浓氨水中,反应的离子方程式是____________________________________;
(4)利用铜片表面催化反应,我国研究人员用六炔基苯为原料,在世界上首次通过化学方法获得全碳材料—石墨炔薄膜(结构片段如图所示),开辟了人工化学合成碳同素异形体的先例。石墨炔中碳原子_________________________的杂化方式。
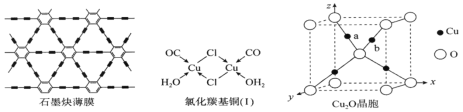
(5)CuCl的盐酸溶液能吸收CO形成氯化羰基亚铜(I),可用于定量测定气体混合物中CO的含量。氯化羰基亚铜(I)中含___________σ键数目。
(6)Cu2O可用于半导体材料。
①Cu2O晶胞(如图所示)中,O原子的配位数为________________;a位置Cu+坐标为(0.25,0.25,0.75),则b位置Cu+坐标_______________________。
②Cu2S与Cu2O具有相似晶体结构,则两者的熔点是Cu2O比Cu2S的_________(填“高”或“低”),请解释原因___________________。
-
下列说法中不正确的是 ( )
A.人类历史上使用最早的合金是青铜,目前世界上使用量最大的合金是钢
B.从金属矿石中提炼金属一般步骤依次是:矿石的富集、精炼、冶炼
C.硫酸的消费量常被视为一个国家工业发达水平的一种标志
D.能源、信息、材料通常被称为新科技革命的三大支柱
-
铜是人类知道最早的金属之一,也是广泛使用的第一种金属。回答下列问题:
(1)镍白铜(铜镍合金)可用于制作仿银饰品。第二电离能I2(Cu)______________Ⅰ2(Ni)(填“>"或 “<”),其原因为______________。
(2)向[Cu(NH3)2]Cl溶液中通入乙炔(C2H2)气体,可生成红棕色沉淀Cu2C2。
①C2H2分子中 键与
键与 键的数目之比为______________;碳原子的杂化方式为______________。
键的数目之比为______________;碳原子的杂化方式为______________。
②写出与Cu2C2中阴离子C22-互为等电子体的一种分子和一种离子______________。
(3)乙二胺(H2N-CH2CH2-NH2)易与Cu2+形成络合物用于Cu2+的定量测定。
①形成的络合物中提供孤对电子的原子为______________(填元素符号)。
②乙二胺中所含元素的电负性由大到小的顺序为______________;乙二胺在水中溶解度较大的原因为______________。
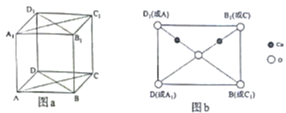
(4)铜与氧构成的某种化合物的立方晶胞如图a所示,图b是沿晶胞对角面取得的截图,晶胞中所有原子均在对角面上。氧原子的配位数为______________,若Cu原子之间最短距离为dpm,阿伏加德罗常数的值为NA,该晶体的密度为______________g·cm-3(列出计算式即可)。
-
我国是世界文明古国,商周时期就制造出了“四羊方尊”、“ 司母戊鼎”等精美青铜器。青铜的主要成分是Cu,还含有少量第ⅣA族的Sn和Pb。回答下列问题:
(1)基态Cu原子的价电子排布图是___________________,基态Sn原子的未成对电子数是Cu 的__________ 倍,Pb位于周期表的______________区。
(2)向CuSO4溶液中加入过量的氨水再加少许乙醇可以析出美丽的蓝色晶体:[Cu(NH3)4]SO4·H2O。
①SO42-中S的杂化方式是___________,晶体所含非金属中电负性最小是__________________。
②请表示出[Cu(NH3)4]2+离子中的全部配位键____________,1mol [Cu(NH3)4]2+中含有_____ molσ键。
③水分子的键角为1050,小于NH3分子键角1070,产生此差异的原因是_______________。
(3)铜晶胞模型如图所示: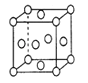 ,Cu晶胞的棱长为bpm,则1个铜晶胞中Cu原子的质量是____g,1个铜晶胞中Cu原子占据的体积为______________pm3。
,Cu晶胞的棱长为bpm,则1个铜晶胞中Cu原子的质量是____g,1个铜晶胞中Cu原子占据的体积为______________pm3。
-
铜及其合金是人类最早使用的金属材料.
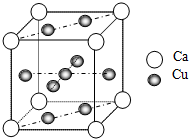
(1)铜原子的核外电子排布式是______.
(2)如图是金属Ca和Cu所形成的某种合金的晶胞结构示意图,则该合金中Ca和Cu的原子个数比为______.
(3)Cu2+能与NH3、H2O、Cl-等形成配位数为4的配合物.
①[Cu(NH3)4]2+中存在的化学键类型有______(填序号).
A、配位键 B、金属键
C、极性共价键 D、非极性共价键 E、离子键
②[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为______.
③某种含Cu2+的化合物可催化丙烯醇制备丙醛的反应:HOCH2CH=CH2CH3CH2CHO,在丙烯醇分子中共有______σ键和______π键.
-
铜合金是人类使用最早的金属材料,铜在化合物中的常见化合价有+l 、+2。已知Cu2O与稀硫酸反应,有红色金属析出且溶液呈蓝色。现向Cu、Cu2O和CuO组成的混合物中,加入1 L 0.6 mol/L HNO3溶液恰好使混合物溶解,同时收集到2240 mL NO气体(标准状况)。请回答下列问题:
(1)写出Cu2O跟稀硝酸反应的离子方程式________________。
(2)若将上述混合物用足量的H2加热还原,所得到固体的质量为________________。
(3)若混合物中含0.1 mol Cu,将该混合物与稀硫酸充分反应,至少消耗H2SO4的物质的量为________________。
(4)若混合物中Cu的物质的量为n mol,则n的取值范围为________________。
-
铜合金是人类使用最早的金属材料,铜在化合物中的常见化合价有+l 、+2。已知Cu2O与稀硫酸反应,有红色金属析出且溶液呈蓝色。现向Cu、Cu2O和CuO组成的混合物中,加入1 L 0.6 mol/L HNO3溶液恰好使混合物溶解,同时收集到2240 mL NO气体(标准状况)。请回答下列问题:
(1)写出Cu2O跟稀硝酸反应的离子方程式 。
(2)若将上述混合物用足量的H2加热还原,所得到固体的质量为 。
(3)若混合物中含0.1 mol Cu,将该混合物与稀硫酸充分反应,至少消耗H2SO4的物质的量为 。
(4)若混合物中Cu的物质的量为n mol,则n的取值范围为 。
-
铜及其合金是人类最早使用的金属材料。
(1)金属铜采取下列哪种方式堆积( )
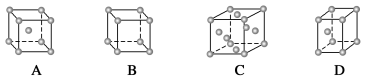
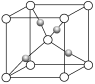
(2)在1个Cu2O晶胞中(结构如上图所示),Cu原子配位数为__________。
(3)科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如下:

①胆矾的化学式用配合物的形式表示为____________。
②胆矾中SO42—的空间构型为________,H2O中O原子的杂化类型为________。
③某兴趣小组称取2.500 g胆矾晶体,逐渐升温使其失水,并准确测定不同温度下剩余固体的质量,得到如图所示的实验结果示意图。下列说法正确的是( )
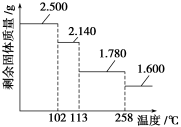
A.晶体从常温升到105 ℃的过程中只有氢键断裂
B.胆矾晶体中形成配位键的4个水分子同时失去
C.120 ℃时,剩余固体的化学式是CuSO4·H2O
D.按胆矾晶体失水时所克服的作用力大小不同,晶体中的水分子可以分为3种
-
(8分)铜合金是人类使用最早的金属材料,铜在化合物中的常见化合价有+l、+2。已知Cu2O与稀硫酸反应,溶液呈蓝色,同时溶液中还存在红色浑浊。现向Cu、Cu2O和CuO组成的混合物中,加入1 L 0.6 mol/L HNO3溶液恰好使混合物溶解,同时收集到2240 mL NO气体(标准状况)。
请回答下列问题:
(1)写出Cu2O跟稀硝酸反应的离子方程式 。
(2)若将上述混合物用足量的H2加热还原,所得到固体的质量为 。
(3)若混合物中含0.1 mol Cu,将该混合物与稀硫酸充分反应,消耗H2SO4的物质的量为 。
(4)若混合物中Cu的物质的量为n mol,则n的取值范围为 。
 ) 可用于鉴别 Cu2+。红氨酸分子中C 原子的价层电子对数目为___; N原子的杂化方式为___; N原子与 H原子形成共价键的电子云对称形式为___ 。
) 可用于鉴别 Cu2+。红氨酸分子中C 原子的价层电子对数目为___; N原子的杂化方式为___; N原子与 H原子形成共价键的电子云对称形式为___ 。



 ,Cu晶胞的棱长为bpm,则1个铜晶胞中Cu原子的质量是____g,1个铜晶胞中Cu原子占据的体积为______________pm3。
,Cu晶胞的棱长为bpm,则1个铜晶胞中Cu原子的质量是____g,1个铜晶胞中Cu原子占据的体积为______________pm3。



