-
化学与生活密切相关。下列叙述错误的是
A.铝制餐具不宜用来蒸煮或长时间存放酸性、碱性或咸的食物
B.放电影时,放映室射到银幕上的光柱的形成属于丁达尔效应
C.可以用乙烯作为水果的催熟剂,使生水果尽快成熟
D.电池不当的充、放电方式会造成电池内容物产生结晶或气泡,使电池容量升高
难度: 简单查看答案及解析
-
阿伏伽德罗常数的值为NA。下列说法正确的是
A.18 g H2O、D2O组成的物质中含有的电子数为10NA
B.0.2 mol铁在足量的氧气中燃烧,转移电子数为0.6NA
C.50 mL 12 mol·L-1盐酸与足量MnO2共热,转移的电子数为0.3NA
D.0.1 mol 熔融的KHSO4中含有0.1NA个阳离子
难度: 中等查看答案及解析
-
下列由实验得出的结论错误的是
实 验
结论
A
向盛有H2O2溶液的试管中,加入少量FeCl3溶液,产生气泡的速率比不加FeCl3溶液的快
FeCl3可以加快H2O2分解的速率,起催化作用
B
将Ba(OH)2·8H2O和NH4Cl晶体在小烧杯中混合搅拌,用手触摸烧杯外壁感觉变凉
Ba(OH)2·8H2O与NH4Cl的反应是吸热反应
C
取少量试液于试管中,加入少量NaOH溶液,在试管口用湿润的红色石蕊试纸检验,红色石蕊试纸未变蓝
溶液中不含NH4+
D
乙醇与金属钠的反应比水与金属钠的反应平缓得多
乙醇羟基中的氢原子不如水分子中的氢原子活泼
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
有机化合物M的分子式为C9H12,其中可能含有苯环的结构有
、
、
等,下列说法错误的是
A.有机物M不管是否含有苯环,在一定条件下都能发生氧化反应
B.有机物M的一种结构为
该有机物不能与溴单质发生加成反应
C.除了上述三种物质,M的含苯环的同分异构体还有5种(不考虑立体异构)
D.
与苯互为同系物
难度: 中等查看答案及解析
-
a、b、c、d是原子序数依次增大的四种元素,a、b是空气中含量最高的两种元素,c的合金是当今世界使用量最大的合金,d的单质常温下为深红棕色液态。下列说法不正确的是
A.向cd2溶液中通入少量氯气会发生置换反应
B.a与b形成的二元化合物并非全部是酸性氧化物
C.单质d保存时需要加水形成液封
D.c的金属活动性弱于第三周期的所有金属元素
难度: 中等查看答案及解析
-
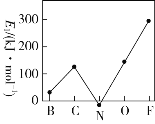
已知pOH=-lg c(OH-),向20 mL 0.1 mol·L-1的氨水中滴加未知浓度的稀硫酸,测得混合溶液的温度、pOH随加入稀硫酸体积的变化如下图所示,下列说法正确的是
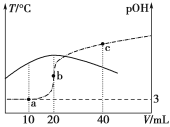
A.稀硫酸的物质的量浓度为0.1 mol·L-1
B.当溶液中pH=pOH时,水的电离程度最大
C.a点时溶液中存在c(NH3·H2O)+2c(OH-)=c(NH4+)+2c(H+)
D.a、b、c三点对应NH4+的水解平衡常数:Kh(c)>Kh(b)>Kh(a)
难度: 中等查看答案及解析
-
中国科学家用蘸墨汁书写后的纸张作为空气电极,设计并组装了轻型、柔性、能折叠的可充电锂空气电池如下左图,电池的工作原理如下图。下列有关说法错误的是
(已知F=96500 C/mol)
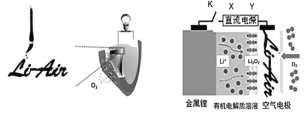
A.放电时,纸张中的纤维素作为电池的正极导电材料
B.充电时,若阳极放出1 mol O2,则有4 mol e-从X电极流出
C.放电时,理论上1 g负极材料能释放的电量约为13786 C
D.充电时,若用铅蓄电池作直流电源,则Y电极材料为PbO2
难度: 中等查看答案及解析
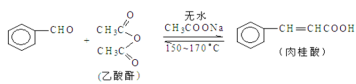 +CH3COOH
+CH3COOH
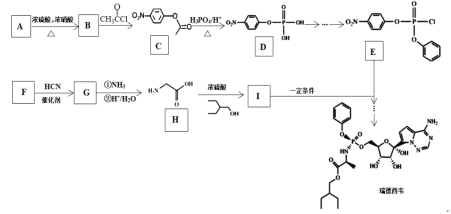
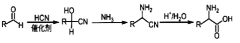
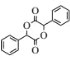 的合成路线______(无机试剂任选)。
的合成路线______(无机试剂任选)。