-
NA表示阿伏加德罗常数的值,下列说法不正确的是
A.28g 乙烯和丙烯混合物中的极性键数目为4NA
B.32g Cu和32g S 充分反应,转移电子数为NA
C.精炼铜时,若阳极失去0.1 NA 个电子,则阴极增重3.2g
D.等物质的量的钠分别在足量的氧气和氯气中燃烧,转移电子数相等
难度: 中等查看答案及解析
-
化学与生产、生活密切相关,下列说法错误的是( )
A.生活污水进行脱氮、脱磷处理可以减少水体富营养化
B.食品袋中装有硅胶的小纸包的作用是防止食品受潮
C.草木灰不能与铵态氮肥混合施用
D.爆竹燃放过程中,硫燃烧直接生成三氧化硫
难度: 简单查看答案及解析
-
用下列实验装置进行相应实验,设计正确且能达到实验目的的是
A.
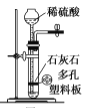 用于实验室制取少量CO2
用于实验室制取少量CO2B.
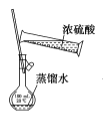 用于配制一定物质的量浓度的硫酸
用于配制一定物质的量浓度的硫酸C.
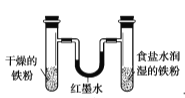 用于模拟生铁的电化学腐蚀
用于模拟生铁的电化学腐蚀D.
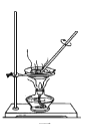 用于蒸干AlCl3溶液制备无水AlCl3
用于蒸干AlCl3溶液制备无水AlCl3难度: 中等查看答案及解析
-
作为“血迹检测小王子”,鲁米诺反应在刑侦中扮演了重要的角色,其一种合成原理如图所示。下列有关说法正确的是
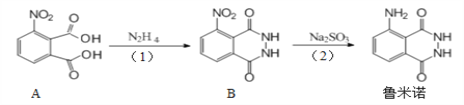
A.鲁米诺的化学式为C8H6N3O2
B.1 mol A分子最多可以与5 mol氢气发生加成反应
C.B中处于同一平面的原子有9个
D.(1)、(2)两步的反应类型分别为取代反应和还原反应
难度: 中等查看答案及解析
-
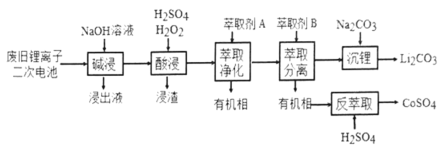
某电动汽车配载一种可充放电的锂离子电池,放电时电池总反应为
下列关于该电池的说法不正确的是( )
A.充电时,若转移
,石墨(
)电极将增重
B.充电时,阳极的电极反应式为
C.放电时,
在电解质中由负极向正极迁移
D.放电时,负极的电极反应式为
难度: 中等查看答案及解析
-
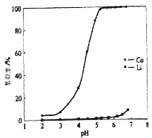
室温下,某二元碱
水溶液中相关组分的物质的量分数随溶液pH变化的曲线如图所示,下列说法错误的是( )
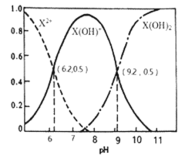
A.
的数量级为
B.
水溶液显碱性
C.等物质的量的
和
混合溶液中
D.在
水溶液中,
难度: 困难查看答案及解析
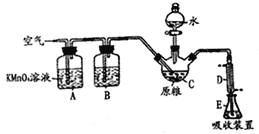
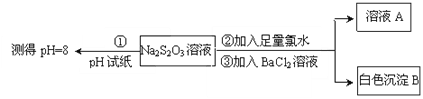
 )的碱性溶液,其作用是______。
)的碱性溶液,其作用是______。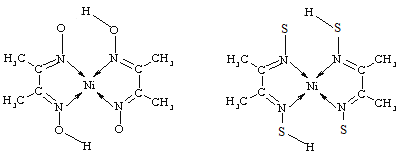
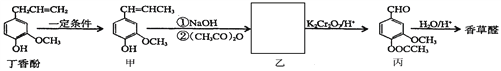
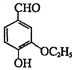 ,相对分子质量=166)的同分异构体丁是一种医药中间体,可在酸性条件下水解。丁的一种水解产物(相对分子质量=152)核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为3∶2∶2∶1,化合物丁的结构简式是______。
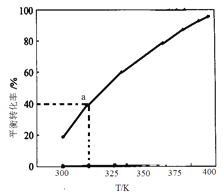
,相对分子质量=166)的同分异构体丁是一种医药中间体,可在酸性条件下水解。丁的一种水解产物(相对分子质量=152)核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为3∶2∶2∶1,化合物丁的结构简式是______。 , 此反应的热化学方程式为:_________
, 此反应的热化学方程式为:_________