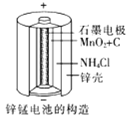
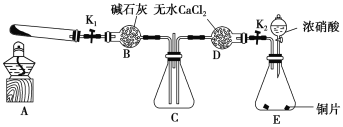
-
下列关于F、Cl、Br、I相关物质性质的比较中,正确的是( )
A. 单质的颜色随核电荷数的增加而变浅
B. 单质的熔、沸点随核电荷数的增加而降低
C. 它们的氢化物的还原性随核电荷数的增加而增强
D. 它们的氢化物的稳定性随核电荷数的增加而增强
难度: 中等查看答案及解析
-
具有相同电子层结构的三种微粒An+、Bn-、C,下列分析正确的是
A. 原子序数关系:C>B>A B. 微粒半径关系:Bn-<An+
C. C微粒是稀有气体元素的原子 D. 原子半径关系是A<B
难度: 简单查看答案及解析
-
下列说法正确的是
A.反应热就是反应中放出的能量
B.在任何条件下,化学反应的焓变都等于化学反应的反应热
C.由C(s,石墨)═C(s,金刚石)△H=+1.9kJ•mol﹣1可知,金刚石比石墨稳定
D.等量的硫蒸气和硫固体分别完全燃烧,前者放出的热量多
难度: 简单查看答案及解析
-
下列现象或事实不能用同一原理解释的是
A.浓硝酸和氯水用棕色试剂瓶保存
B.硫化钠和亚硫酸钠固体长期暴露在空气中变质
C.常温下铁和铂都不溶于浓硝酸
D.SO2和Na2SO3溶液都能使氯水褪色
难度: 中等查看答案及解析
-
下列各组化合物中,化学键的类型完全相同的是( )
①CaCl2 和Na2S ②CO2 和CS2 ③Na2O 和Na2O2 ④HCl 和NaOH
A.①② B.①③ C.②③ D.②④
难度: 中等查看答案及解析
-
甲烷燃烧的热化学方程式为CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890kJ/mol,若以NA代表阿伏加德罗常数,则下列说法中正确的是
A.有4NA个电子转移时,放出890 kJ的能量
B.有NA个C-H键断裂时,放出890 kJ的能量
C.有2NA个H2O(l)生成时,放出890 kJ的能量
D.有NA个C、O间的共用电子对生成时,放出890 kJ的能量
难度: 简单查看答案及解析
-
《本草经集注》中记载了区别硝石(KNO3)和芒硝(Na2SO4):“以火烧之,紫青烟起,乃真硝石也”,这是运用了硝石的
A.焰色反应 B.氧化性 C.还原性 D.不稳定性
难度: 简单查看答案及解析
-
下列设备工作时,将化学能转化为热能的是( )
A.
 硅太阳能电池 B.
硅太阳能电池 B.  锂离子电池
锂离子电池C.
 太阳能集热器 D.
太阳能集热器 D.  燃气灶
燃气灶难度: 简单查看答案及解析
-
氧可与许多元素形成化合物,下列有关叙述错误的是( )
A.水分子的结构式为:
B.H2O2的电子式:

C.Na2O2的电子式为:
D.在MgO晶体中,O2-的结构示意图可表示为
难度: 简单查看答案及解析
-
能源可划分为一次能源和二次能源,直接来自于自然界的能源称为一次能源;需依靠其他能源的能量间接制取的能源称为二次能源。下列叙述正确的是( )
A.水煤气是二次能源 B.水力是二次能源
C.天然气是二次能源 D.电能是一次能源
难度: 简单查看答案及解析
-
下列热化学方程式中△H的绝对值能表示可燃物的燃烧热的是( )
A.H2(g)+Cl2(g)=2HCl(g) △H=-184.6kJ/mol B.C(s)+
O2(g)=CO(g) △H=-110.5kJ/mol
C.2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ/mol D.CO(g)+
O2(g)=CO2(g) △H=-283kJ/mol
难度: 简单查看答案及解析
-
中国科学技术名词审定委员会已确定第116号元素Lv的名称为鉝,关于核素
Lv的叙述错误的是
A.原子序数为116 B.中子数为177
C.核外电子数为116 D.该元素的相对原子质量为293
难度: 简单查看答案及解析
-
今年是门捷列夫发现元素周期律150周年。下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法错误的是
A.原子半径:W<X
B.常温常压下,Y单质为固态
C.气态氢化物热稳定性:Z<W
D.X的最高价氧化物的水化物是强碱
难度: 中等查看答案及解析
-
短周期主族元素 X、Y、Z、W 原子序数依次增大,X 是地壳中含量最多的元素,Y 原子的最外层只有一个电子,Z 位于元素周期表ⅢA族,W 与X属于同一主族。下列说法正确的是
A. 原子半径:r(W) > r(Z) > r(Y)
B. 由X、Y 组成的化合物中均不含共价键
C. Y 的最高价氧化物的水化物的碱性比Z的弱
D. X 的简单气态氢化物的热稳定性比W的强
难度: 简单查看答案及解析
-
类推思想在化学学习与研究中经常被采用,但类推出的结论是否正确最终要经过实验的验证。以下类推的结论中正确的是( )
A.SO2能使酸性KMnO4溶液褪色,故CO2也能使酸性KMnO4溶液褪色
B.盐酸与镁反应生成氢气,故硝酸与镁反应也生成氢气
C.SO2能使品红溶液褪色,故CO2也能使品红溶液褪色
D.常温下浓硫酸能使铁和铝钝化,故常温下浓硝酸也能使铁和铝钝化
难度: 中等查看答案及解析
-
下列装置应用于实验室制二氧化硫并验证其漂白性的实验,其中能达到实验目的的是
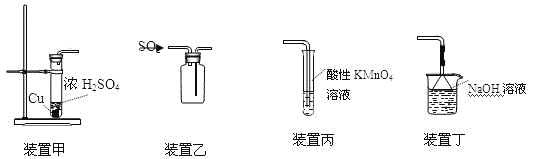
A.用装置甲制取二氧化硫
B.用装置乙收集二氧化硫
C.用装置丙验证二氧化硫的漂白性
D.用装置丁吸收二氧化硫
难度: 中等查看答案及解析
-
某小组设计如图装置(盐桥中盛有浸泡了KNO3溶液的琼脂)研究电化学原理。下列叙述正确的是
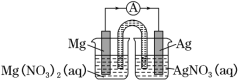
A. 银片为负极,发生的反应为Ag++e-=Ag
B. 进行实验时,琼脂中K+移向Mg(NO3)2溶液
C. 用稀硫酸代替AgNO3溶液,可形成原电池
D. 取出盐桥,电流表依然有偏转
难度: 中等查看答案及解析
-
目前,太原市电能的主要来源是火力发电.下列关于火力发电过程中能量转化关系的描述,正确的是( )
A.化学能转化成机械能再转化成电能
B.化学能转化成热能再转化成电能
C.化学能转化成机械能再转化成热能再到机械能
D.化学能转化成热能再转化成机械能再到电能
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.CO、NO、NO2都是大气污染气体,在空气中都能稳定存在
B.NH3汽化时吸收大量的热,因此,氨常用作制冷剂
C.CO2、NO2或SO2都会导致酸雨的形成
D.活性炭、SO2、Na2O2都能使品红溶液褪色,原理不同
难度: 中等查看答案及解析
-
下列关于物质性质的比较,不正确的是( )
A.碱性强弱:KOH>NaOH>LiOH B.原子半径大小:Na>S>O
C.酸性强弱:HIO4>HBrO4>HClO4 D.稳定性:HF>HCl>H2S
难度: 简单查看答案及解析
-
镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O
Cd(OH)2+ 2Ni(OH)2。有关该电池的说法正确的是
A.充电时阳极反应:Ni(OH)2-e—+ OH-=" NiOOH" + H2O
B.充电过程是化学能转化为电能的过程
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH-向正极移动
难度: 中等查看答案及解析
-
氢氧燃料电池用于航天飞机,电极反应产生的水,经冷凝后可作为航天员的饮用水,其电极反应如下:负极:2H2+4OH--4e-===4H2O;正极:O2+2H2O+4e-===4OH-。当得到1.8 L饮用水时,电池内转移的电子数约为( )
A.3.6 mol B.100 mol C.200 mol D.400 mol
难度: 中等查看答案及解析
-
2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系。下列叙述错误的是
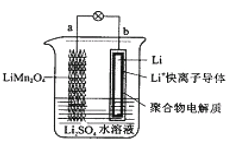
A.a为电池的正极
B.电池充电反应为LiMn2O4
Li1-xMn2O4+xLi
C.放电时,a极锂的化合价发生变化
D.放电时,溶液中Li+从b向a迁移
难度: 中等查看答案及解析
-
电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下。下列说法不正确的是
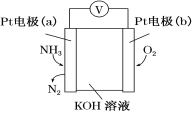
A.O2在电极b上发生还原反应
B.溶液中OH-向电极a移动
C.反应消耗的NH3与O2的物质的量之比为4∶5
D.负极的电极反应式为2NH3-6e-+6OH-=N2+6H2O
难度: 中等查看答案及解析