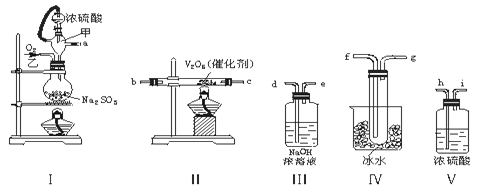
-
一氯代物的同分异构体有两种,二氯代物的同分异构体有四种的烷烃是( )
A.乙烷 B.丙烷 C.正丁烷 D.正戊烷
难度: 中等查看答案及解析
-
制出了第一张元素周期表的科学家是( )
A.勒夏特列 B.汤姆生 C.阿伏加德罗 D.门捷列夫
难度: 简单查看答案及解析
-
据科学家预测,月球的土壤中吸附着数百万吨的
,每百吨He核聚变所释放出的能量相当于目前人类一年消耗的能量。在地球上,氦元素主要以
的形式存在。下列说法正确的是( )
A.
原子核内含有4个质子
B.
和
互为同位素
C.
原子核内含有3个中子
D.
的最外层电子数为2,所以
具有较强的金属性
难度: 简单查看答案及解析
-
下列物质分类正确的是
A.SO2、SiO2、CO均为酸性氧化物 B.稀豆浆、硅酸、氯化铁溶液均为胶体
C.烧碱、冰醋酸、蔗糖均为电解质 D.盐水、水玻璃、氨水均为混合物
难度: 中等查看答案及解析
-
下列物质中,既有离子键,又有共价键的盐是
A. NaOH B. KHSO4 C. CaO2 D. CCl4
难度: 简单查看答案及解析
-
NA为阿伏加德罗常数,下列有关说法正确的是
A.常温下,7.8g固体Na2O2中,含有的阴阳离子总数为0.4NA
B.4℃时,18g2H216O中含有共用电子对数为2NA
C.用金属铁、Cu片、稀硫酸组成原电池,当金属铁质量减轻5.6g时,流过外电路的电子为0.3NA
D.1 mol N5+含有的电子数为34NA
难度: 中等查看答案及解析
-
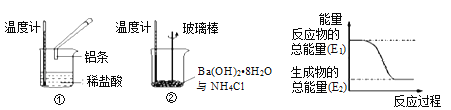
根据下列信息判断氢气燃烧生成水时的热量变化,其中一定正确的是

A.H2O分解为H2与O2时放出热量
B.1molH2与0.5molO2完全反应生成1mol H2O时放出热量245 kJ
C.甲、乙、丙中物质所具有的总能量大小关系为甲>乙>丙
D.氢气和氧气的总能量小于水的能量
难度: 中等查看答案及解析
-
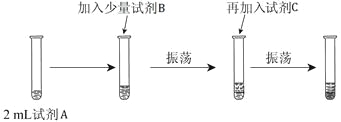
根据下列实验或实验操作和现象,所得结论正确的是
实验或实验操作
现象
实验结论
A
用大理石和盐酸反应制取CO2气体,立即通入一定浓度的Na2SiO3溶液中
出现白色沉淀
H2CO3的酸性比H2SiO3的酸性强
B
向某溶液先滴加硝酸酸化,再滴加BaCl2溶液
出现白色沉淀
原溶液中含有SO42-、SO32-、HSO3-中的一种或几种
C
将纯Zn片与纯Cu片用导线连接,浸入到稀硫酸溶液中
Cu片表面产生大量气泡
金属性:Zn>Cu
D
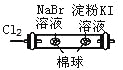
左边棉球变为橙色,右边棉球变为蓝色
氧化性:Cl2>Br2>I2
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
X、Y、Z和W代表原子序数依次增大的四种短周期主族元素。它们满足以下条件:①在元素周期表中,Z与Y、W均相邻;②X、Y、W分别位于不同周期;③Y、Z、W三种元素的原子最外层电子数之和为17。下列说法错误的是
A. X、Y、Z能形成共价化合物
B. Y和Z元素的原子半径大小顺序为Y > Z
C. X与Y、Z之间形成的核外电子总数为10的微粒只有YX3和X2Z
D. Z、W元素的最简单氢化物的沸点和稳定性均为H2Z > H2W
难度: 中等查看答案及解析
-
下列图示与对应的叙述不相符合的是( )

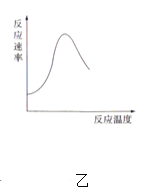
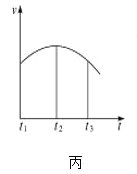
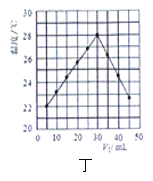
A.图甲表示燃料燃烧反应的能量变化
B.图乙表示酶催化反应的反应速率随反应温度的变化
C.图丙表示除去氧化膜的镁条投入到稀盐酸中,反应速率v随时间t的变化曲线
D.图丁表示某温度下V1mLl.0 mol/L HC1溶液和V2 mL1.5mol/L的NaOH溶液混合均匀后溶液温度随V1的变化趋势(V1+V2=50mL)
难度: 简单查看答案及解析
-
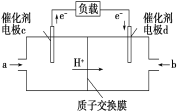
电化学气敏传感器可用于监测环境中NH3的含量,其工作原理如图所示,其中NH3被氧化为常见无毒物质。下列说法错误的是( )

A. 溶液中OH-向电极a移动
B. 电极b上发生还原反应
C. 负极的电极反应式为2NH3-6e-+6OH-===N2+6H2O
D. 理论上反应消耗的NH3与O2的物质的量之比为3∶4
难度: 中等查看答案及解析
-
一种有机物的分子式为C4H4,分子结构如图所示,将该有机物与适量氯气混合后光照,生成的氯代物的种类共有( )
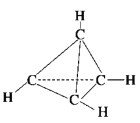
A.2种 B.4种 C.5种 D.6种
难度: 简单查看答案及解析
-
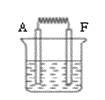
按下图装置进行实验,若x轴表示流入正极的电子的物质的量,则y轴可以表示( )
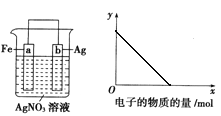
①c(Ag+) ②c(NO3-) ③a棒的质量 ④b棒的质量 ⑤溶液的质量
A.①③ B.②④ C.①③⑤ D.②④⑥
难度: 中等查看答案及解析
-
已知三角锥形分子E和直线形分子G反应,生成两种直线形分子L和M(组成E、G、L、M分子的元素原子序数均小于10),如右图:
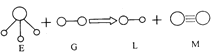
下列判断错误的是
A.G是最活泼的非金属单质 B.L能使紫色石蕊试液变红色
C.E能使紫色石蕊试液变蓝色 D.M是化学性质很活泼的单质
难度: 中等查看答案及解析
-
元素周期表有许多有趣的编排方式,有同学将短周期元素按照原子序数递增的顺序进行排列得到如图所示的“蜗牛”元素周期表。图中每个“·”代表一种元素(图中字母不表示元素符号)。下列说法正确的是
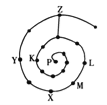
A.L、M、X三元素位于同一族
B.K、Z两元素的氢化物的水溶液都显酸性
C.Y元素对应的氢化物比K元素对应的氢化物沸点低
D.K、L、X、Z四种元素离子半径大小顺序是Z->L+>X3+>K3-
难度: 中等查看答案及解析