-
能源是现代文明的原动力,通过化学方法可以使能量按人们所期望的形式转化,从而开辟新能源和提高能源的利用率,请回答下列问题。
(1)①工业合成氨反应:N2+3H2 2NH3是放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知1molN2完全反应生成NH3可放出92kJ热量。如果将10molN2和足量H2混合,使其充分反应,放出的热量___(填“大于”、“小于”或“等于”)920kJ。
2NH3是放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知1molN2完全反应生成NH3可放出92kJ热量。如果将10molN2和足量H2混合,使其充分反应,放出的热量___(填“大于”、“小于”或“等于”)920kJ。
②已知断开1molN N键吸收的能量为945.6kJ,形成1molN﹣H键放出的能量为391kJ,根据化学方程式N2+3H2
N键吸收的能量为945.6kJ,形成1molN﹣H键放出的能量为391kJ,根据化学方程式N2+3H2 2NH3,生成标准状况下44.8LNH3时放出的能量为92.4kJ,则断开1molH﹣H键吸收的能量是___。
2NH3,生成标准状况下44.8LNH3时放出的能量为92.4kJ,则断开1molH﹣H键吸收的能量是___。
(2)某实验小组同学进行如图1所示实验,以检验化学反应中的能量变化。请根据你掌握的反应原理判断,②中的温度___(填“升高”或“降低”)。反应过程___(填“①”或“②”)的能量变化可用图2表示。
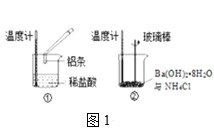
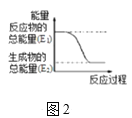
(3)已知化学反应A2(g)+B2(g)═2AB(g)的能量变化如图2所示,该反应是___(填“吸热”或“放热”)反应。
(4)用CH3OH和O2组合形成的质子交换膜燃料电池的结构如图3所示:
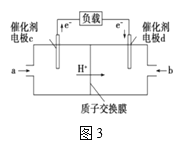
①则d电极是___(填“正极”或“负极”),c电极的电极反应式为___。
②若线路中转移2mol电子,则该燃料电池理论上消耗的O2在标准状况下的体积为___L。
-
能源是现代文明的原动力,通过化学方法可以使能量按人们所期望的形式转化,从而开辟新能源和提高能源的利用率,请回答下列问题。
(1)工业合成氨反应:N2+3H2  2NH3是放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知1 mol N2完全反应生成NH3可放出92 kJ热量。如果将10 mol N2和足量H2混合,使其充分反应,放出的热量________(填“大于”、“小于”或“等于”)920kJ。
2NH3是放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知1 mol N2完全反应生成NH3可放出92 kJ热量。如果将10 mol N2和足量H2混合,使其充分反应,放出的热量________(填“大于”、“小于”或“等于”)920kJ。
(2)实验室模拟工业合成氨时,在容积为2 L的密闭容器内,反应经过10 min后,生成10 mol NH3
①则用N2表示的化学反应速率为__________________。
②一定条件下,当该反应进行到最大限度时,下列说法正确的是______(填编号)
a.N2的转化率达到最大值
b.N2、H2和NH3的体积分数之比为1 : 3 : 2
c.体系内气体的密度保持不变
d.体系内物质的平均相对分子质量保持不变
(3)某实验小组同学进行如下图所示实验,以检验化学反应中的能量变化。请根据你掌握的反应原理判断,②中的温度_______(填“升高”或“降低”)。反应过程____(填“①”或“②”)的能量变化可用图表示。
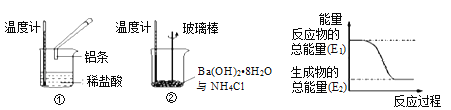
(4)用CH4和O2组合形成的质子交换膜燃料电池的结构如图:
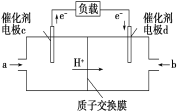
①则d电极是____(填“正极” 或“负极”),c电极的电极反应式为_____________________________。
②若线路中转移2 mol电子,则该燃料电池理论上消耗的O2在标准状况下的体积为______L。
-
能源是现代文明的原动力,通过化学方法可以使能量按人们所期望的形式转化,从而开辟新能源和提高能源的利用率。
(1)氢气燃烧,该反应是___反应(填“吸热”或“放热”),这是由于反应物的总能量___(填“大于”“小于”或“等于”)生成物的总能量;从化学反应的本质来看,是由于断裂反应物中的化学键吸收的总能量___(填“大于”“小于”或“等于”)形成产物的化学键放出的总能量。
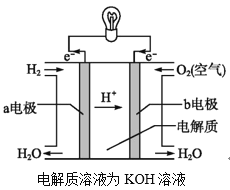
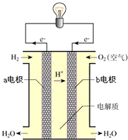
(2)通过氢气的燃烧反应,可以把氢气中储存的化学能转化为热能,如果将该氧化还原反应设计成原电池装置,就可以把氢气中储存的化学能转化为电能,如图就是能够实现该转化的装置,被称为氢氧燃料电池。
该电池的正极是___(填“a电极”或“b电极”),电极反应式为___,该电极上的物质发生反应的反应类型是___(填“氧化反应”或“还原反应”)。
-
(5分)能源是现代文明的原动力,通过化学方法可以使能量按人们所期望的形式转化,从而开辟新能源和提高能源的利用率。
(1))氢气在燃烧时,放出大量热量,说明该反应是 热反应,这是由于反应物的总能量 生成物的总能量(填“大于”、“小于”或“等于”,下同);从化学反应的本质角度来看,由于断裂反应物中的化学键吸收的总能量 形成产物的化学键放出的总能量
(2)氢气被公认为是21世纪代替矿物燃料的理想能源,5.2g氢气燃烧时放出286kJ热量,而每千克汽油燃烧时放出的热量为46000kJ。试据此分析氢气作为能源代替汽油的优势
。
-
能源是现代文明的原动力,通过化学方法可使能量按人们所期望的形式转化,从而开辟新能源和提高能量转化率。请回答下列问题:
(1)能源危机是当前全球性的问题,“开源节流”是应对能源危机的重要举措。下列做法有助于能源“开源节流”的是_______(填序号)。
a.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
b.大力开采煤、石油和天然气以满足人们日益增长的能源需求
c.开发太阳能、水能、风能、地热能等新能源,减少使用煤、石油等化石燃料
d.减少资源消耗,增加资源的重复使用、资源的循环再生
(2)化学反应的本质是旧的化学键断裂,新的化学键形成。已知断开1mo1H-H键、1molN N键、lmolN-H键分别需要吸收的能量为436kJ、946kJ、391kJ。那么生成1mo1 NH3需___________(填“放出”或“吸收”)__________kJ 的热量。
N键、lmolN-H键分别需要吸收的能量为436kJ、946kJ、391kJ。那么生成1mo1 NH3需___________(填“放出”或“吸收”)__________kJ 的热量。
(3)已知一定条件下,白磷转化为红磷释放出能量,故白磷比红磷稳定性_____(填“强”、“弱”)
(4)化学电源在生产生活中有着广泛的应用。
①根据构成原电池的本质判断,如下反应可以设计成原电池的是___________。(填序号)
A.NaOH+HCl = NaCl+H2O B.2CO+O2 =2CO2
C.2H2O=2H2↑+O2↑ D.Cu+2AgNO3=2Ag+Cu(NO3)2
②为了探究化学反应中的能量变化,某同学设计了如下两个实验(如下图)。有关实验现象,下列说法正确的是:_____(填序号)
A.图I和图II的气泡均产生于锌棒表面
B.图II中产生气体的速率比I快
C.图I中温度计的示数高于图II的示数
D.图I和图II中温度计的示数相等,且均高于室温
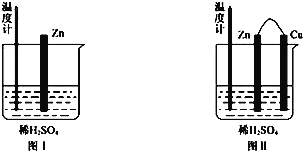
③燃料电池是一种高效、环境友好的供电装置。以甲醇(CH3OH)为燃料的电池中,电解质溶液为碱性,负极的反应式为:_______________________________,若该电池的效率为60%,当外电路转移1.2mol电子,消耗的氧气的体积为_________________ L(标准状况)
-
能源是现代文明的原动力,通过化学方法可使能量按人们所期望的形式转化,从而开辟新能源和提高能量转化率。请回答下列问题:
(1)能源危机是当前全球性的问题,“开源节流”是应对能源危机的重要举措。下列做法有助于能源“开源节流”的是__(填序号)。
a.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
b.大力开采煤、石油和天然气以满足人们日益增长的能源需求
c.开发太阳能、水能、风能、地热能等新能源,减少使用煤、石油等化石燃料
d.减少资源消耗,增加资源的重复使用、资源的循环再生
(2)已知一定条件下,白磷转化为红磷释放出能量,故白磷比红磷稳定性___(填“强”、“弱”)
-
能源是现代文明的原动力,通过化学方法可以使能量按人们所期望的形式转化,从而开辟新能源和提高能源的利用率。
(1)氢气在O2中燃烧的反应是_____热反应(填“放”或“吸”),这是由于反应物的总能量_____生成物的总能量(填“大于”、“小于”或“等于”,下同);
(2)从化学反应的本质角度来看,是由于断裂反应物中的化学键吸收的总能量______形成产物的化学键放出的总能量。已知破坏1 mol H-H键、1 mol O=O键、1 mol H-O键时分别需要吸收436 kJ、498 kJ、463 kJ的能量。则2 mol H2(g)和1mol O2(g)转化为2mol H2O(g)时放出的热量为_______。
-
能源是现代文明的原动力,通过化学方法可以使能量按人们所期望的形式转化,从而开辟新能源和提高能源的利用率.
(1)氢气在O2中燃烧的反应是______热反应(填“放”或“吸”),这是由于反应物的总能量______生成物的总能量(填“大于”、“小于”或“等于”,下同);
(2)从化学反应的本质角度来看,氢气的燃烧是由于断裂反应物中的化学键吸收的总能量______形成产物的化学键放出的总能量。已知破坏1mol H-H键、1mol O=O键、1mol H-O键时分别需要吸收a kJ、b kJ、c kJ的能量。则2mol H2(g)和1mol O2(g)转化为2mol H2O(g)时放出的热量为
____________________kJ。
(3)通过氢气的燃烧反应,可以把氢气中蕴含的化学能转化为热能,如果将该氧化还原反应设计成原电池装置,就可以把氢气中蕴含的化学能转化为电能,下图就是能够实现该转化的装置(其中电解质溶液为KOH溶液),被称为氢氧燃料电池.该电池的正极是___(填a或b),负极反应式为______________。
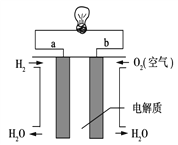
(4)若将右图中的氢氧燃料电池用固体金属氧化物陶瓷作电解质(能够传导O2-),已知正极上发生的电极反应式为:O2+4e-===2O2-则负极上发生的电极反应式为________;电子从________极(填a或b)流出。
-
能源是现代文明的原动力,通过化学方法可以使能量按人们所期望的形式转化,从而开辟新能源和提高能源的利用率.
(1)氢气在燃烧时,放出大量热量,说明该反应是________热反应,这是由于反应物的总能量________生成物的总能量(填“大于”、“小于”或“等于”,下同);从化学反应的本质角度来看,是由于断裂反应物中的化学键吸收的总能量________形成产物的化学键放出的总能量.
(2)氢气被公认为是21世纪代替矿物燃料的理想能源,5.2g氢气燃烧时放出286kJ热量,而每千克汽油燃烧时放出的热量为46000kJ.试据此分析氢气作为能源代替汽油的优势
________.
(3)通过氢气的燃烧反应,可以把氢气中蕴含的化学能转化为热能,如果将该氧化还原反应设计成原电池装置,就可以把氢气中蕴含的化学能转化为电能,下图就是能够实现该转化的装置,被称为氢氧燃料电池.该电池的正极是________(填a电极或b电极),其电极反应为________.
-
能源是现代文明的原动力,通过化学方法可以使能量按人们所期望的形式转化,从而开辟新能源和提高能源的利用率。
(1)氢气在O2中燃烧的反应是______热反应(填“放”或“吸”),这是由于反应物的总能量______生成物的总能量(填“大于”、“小于”或“等于”,下同);
(2)从化学反应的本质角度来看,是由于断裂反应物中的化学键吸收的总能量______形成产物的化学键放出的总能量.已知破坏1mol H-H键、1mol O=O键、1mol H-O键时分别需要吸收436kJ、498kJ、463kJ的能量。则2mol H2(g)和1mol O2(g)转化为2mol H2O(g)时放出的热量为 。
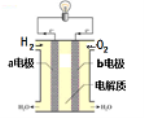
(3)通过氢气的燃烧反应,可以把氢气中蕴含的化学能转化为热能,如果将该氧化还原反应设计成原电池装置,就可以把氢气中蕴含的化学能转化为电能,下图就是能够实现该转化的装置(其中电解质溶液为KOH溶液),被称为氢氧燃料电池.该电池的正极是______
(填a电极或b电极),负极反应式为______。
(4)某种氢氧燃料电池是用固体金属氧化物陶瓷作电解质,已知正极上
发生的电极反应式为:O2+4e-===2O2-则负极上发生的电极反
应式为________;电子从该极________(填“流入”或“流出”)。
2NH3是放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知1 mol N2完全反应生成NH3可放出92 kJ热量。如果将10 mol N2和足量H2混合,使其充分反应,放出的热量________(填“大于”、“小于”或“等于”)920kJ。









