-
化学与生活、科技及环境密切相关。下列说法正确的是( )
A.2020年3月9日,发射了北斗系统第五十四颗导航卫星,其计算机的芯片材料是一种有机高分子材料
B.白葡萄酒含维生素C等多种维生素,通常添加微量
的目的是防止营养成分被氧化
C.酒精与84消毒液混合,可增强杀灭新型冠状病毒效果
D.聚合硫酸铁
,是新型絮凝剂,可用来杀灭水中病菌
难度: 中等查看答案及解析
-
2,6-二甲基苯氧乙酸是合成抗新型冠状病毒药物洛匹那韦的原料之一,其结构简式如图所示,有关2,6-二甲基苯氧乙酸说法正确的是( )
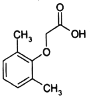
A.该分子所有原子可能处于同一平面 B.该分子苯环上一氯代物有3种
C.该分子能使酸性高锰酸钾溶液褪色 D.该分子与苯甲酸互为同系物
难度: 中等查看答案及解析
-
一种新型漂白剂(如下图)可用于漂白羊毛等,其中W、Y、Z为不同周期不同主族的短周期元素,W、Y、Z的最外层电子数之和等于X的最外层电子数,W、X对应的简单离子核外电子排布相同。下列叙述正确的是( )
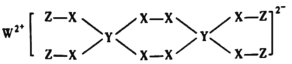
A.少量W单质保存在煤油中
B.W、X、Y对应原子半径顺序为:W>X>Y
C.该漂白剂中各元素均满足8电子稳定结构
D.Y的最高价氧化物对应水化物的化学式为
难度: 中等查看答案及解析
-
设
为阿伏加德罗常数的值。下列叙述正确的是( )
A.已知
;
将2NA个CO与NA个O2混合充分反应放出akJ的热量
B.t℃时,1LpH=6的纯水中含OHˉ数为10-6NA
C.标准状况下,2.24L甲醇中含有C-H键的数目为0.3NA
D.1L0.1mol/L的氢碘酸中含碘化氢分子数为0.1NA
难度: 简单查看答案及解析
-
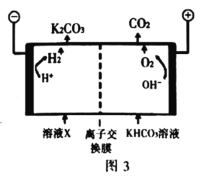
2019年2月27日至3月1日,第十届日本国际二次电池展在日本东京举行,各种新型二次电池在东京有明展览中心展出,其中以
为代表的新型可充电钠离子电池,格外引人注意,其放电工作原理如图所示。下列说法正确的是( )
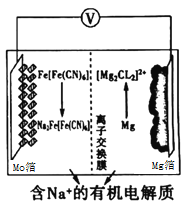
A.放电时,正极反应式为:
B.放电时,电子自Mg箔流出,经含Na+的电解质流向Mo箔
C.充电时,Na+通过离子交换膜从右室移向左室
D.充电时,Mo箔接电源的负极
难度: 中等查看答案及解析
-
下列实验中,现象及结论都正确,且二者之间有因果的是( )
选项
实验操作
现象
结论
A
将少量Na2SO3样品溶于水,滴加足量盐酸酸化的Ba(NO3)2溶液
有白色沉淀产生
Na2SO3已变质
B
将AlCl3溶液加热蒸干
得到白色固体
成分为纯净的AlCl3
C
蘸有浓氨水的玻璃棒靠近X
有白烟产生
X一定是浓盐酸
D
常温下,向等体积、等浓度的NaHCO3和CH3COONa溶液中分别滴加2滴酚酞
两份溶液均变红,NaHCO3溶液红色更深
常温下的水解平衡常数:
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
25℃时,将浓度均为0.1mol/L、体积分别为Va和Vb和的HX溶液与NH3·H2O溶液按不同体积比混合,保持Va+Vb=100mL,Va、Vb与混合液的pH的关系如图所示。下列说法不正确的是( )
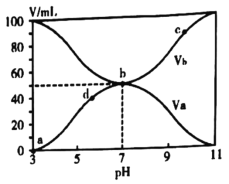
A.HX为弱酸
B.b点:
C.b→c点过程中存在:
D.c、d两点:
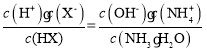 值相等
值相等难度: 困难查看答案及解析
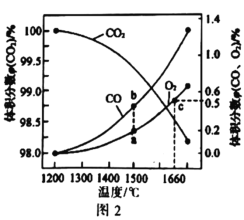
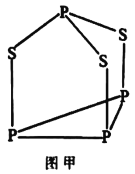
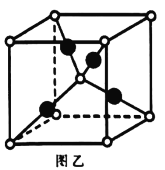
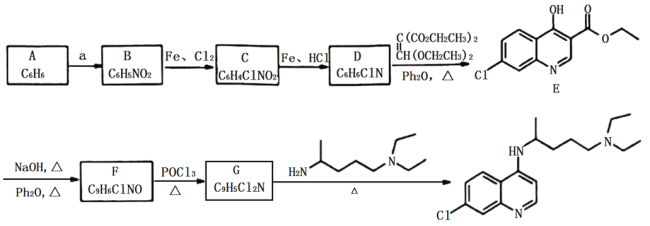
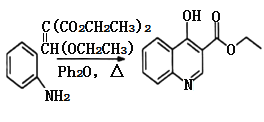
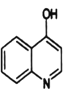
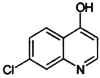 ;②分子中环状结构上只有三个取代基。写出其中任意两种结构简式____、______。
;②分子中环状结构上只有三个取代基。写出其中任意两种结构简式____、______。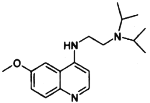 )是治疗血吸虫病的药物,参照上述
)是治疗血吸虫病的药物,参照上述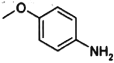 )和N,N-二异丙基乙二胺(
)和N,N-二异丙基乙二胺(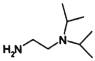 )为起始原料制备有机J的合成路线_______________________(无机试剂任意选用)。
)为起始原料制备有机J的合成路线_______________________(无机试剂任意选用)。