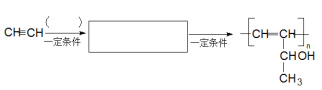
-
用70%~75%的酒精灭菌消毒,使细菌和病毒失去生理活性,该变化属于蛋白质的
A.水解反应 B.变性 C.盐析 D.颜色反应
难度: 简单查看答案及解析
-
化学反应过程中的能量变化如图所示,以下说法中正确的是
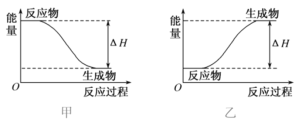
A.图甲表示的是吸热反应 B.图乙表示的是放热反应
C.图甲中ΔH<0 D.图乙中ΔH<0
难度: 简单查看答案及解析
-
在1L的密闭容器中进行反应A (g) + 3B (g)⇌2C (g),0~2 min内A的物质的量由2 mol减小到0.8 mol,则用A的浓度变化表示的反应速率为
A.1.2 mol / ( L·min ) B.1 mol / ( L·min )
C.0.6 mol / ( L·min ) D.0.4 mol / ( L·min )
难度: 简单查看答案及解析
-
一定条件下的密闭容器中发生反应:2SO2(g) + O2(g)⇌2SO3(g) ,若其他条件不变,下列措施会使该反应速率减小的是
A.升高温度 B.增大O2浓度 C.加入催化剂 D.减小压强
难度: 简单查看答案及解析
-
工业合成氨中常采用下列措施,其中不能用化学平衡移动原理解释的是
A.使用铁触媒做催化剂 B.压强增至20 MPa—50 MPa
C.将氨液化分离 D.及时补充氮气和氢气
难度: 中等查看答案及解析
-
下列化学用语或图示表达不正确的是
A.CH4分子的比例模型:
B.2-丁烯的反式结构:
C.羟基的结构简式:-OH D.聚丙烯的结构简式:
难度: 中等查看答案及解析
-
某温度下发生的反应:2C2H2(g)+5O2(g)⇌4CO2(g)+2H2O(g) △H = -2599 kJ·mol-1,下列描述不正确的是
A.该反应是放热反应 B.增大c(O2),K增大
C.K随温度升高而减小 D.可通过Qc与K之间的大小关系判断反应的移动方向
难度: 中等查看答案及解析
-
氮化硅陶瓷能代替金属制造发动机的耐热部件。工业上用化学气相沉积法制备氮化硅,其反应如下:3SiCl4(g)+2N2(g)+6H2(g)
Si3N4(s)+12HCl(g) △H<0。若在恒压绝热容器中反应,下列选项表明反应一定已达化学平衡状态的是( )
A.容器的温度保持不变 B.容器的压强保持不变
C.υ正(N2)=6υ逆(HCl) D.容器内的气体c(N2)∶c(H2)∶c(HCl)=1∶3∶6
难度: 困难查看答案及解析
-
阿斯巴甜是一种具有清爽甜味的有机化合物,结构简式如图所示。下列说法不正确的是( )
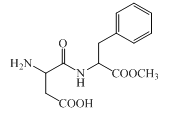
A.分子式为C14H18N2O5
B.不存在顺反异构
C.能发生取代和消去反应
D.1 mol阿斯巴甜完全水解最多消耗3 mol NaOH
难度: 中等查看答案及解析
-
下图是利用太阳能实现燃烧产物重新组合的构想,可以节约燃料,缓解能源危机。 在此构想的物质循环中太阳能最终转化为
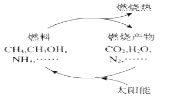
A.热能 B.生物能 C.化学能 D.电能
难度: 中等查看答案及解析
-
向2 L的密闭容器中充入1mol A和1mol B,反应 A(g) + B(g)⇌C(g) + D(g) ΔH的平衡常数(K)和温度(T)的关系如下:
温度/ ℃
700
800
900
平衡常数
0.1
X
1
800℃时,经5s反应达到平衡状态,此时B的平均反应速率v(B)=0.04 mol/(L·s)。下列说法不正确的是
A.平衡时,c(B)为0.6 mol·L-1
B.800℃时平衡常数X=4/9
C.ΔH >0
D.900℃该反应达到平衡状态时,A的物质的量为0.5 mol
难度: 中等查看答案及解析
-
一定条件下的可逆反应:A(g) +3 B(g)⇌2C(g) ΔH=-a kJ·mol−1。下列说法正确的是
A.该反应达到最大限度时,c(B)=3c(A)
B.升高温度时,平衡逆向移动,正反应速率减小,逆反应速率增加
C.该条件下,将1mol A和3mol B投入密闭容器中充分反应,放出a kJ的热量
D.容器压强不变,充入少量Ar气(Ar气与A、B、C气体都不反应),平衡逆向移动
难度: 中等查看答案及解析
-
可逆反应2NO2 (g) ⇌N2O4 (g) ΔH= −56.9 kJ·mol−1在平衡移动时的颜色变化可以用来指示放热过程和吸热过程。某同学的部分实验报告如下。

1.向左侧烧杯中加入NH4NO3晶体,甲瓶的红棕色变浅。
2.向右侧烧杯中加入CaO固体,乙瓶的红棕色变深。
下列说法不正确的是
A.甲瓶的红棕色变浅,说明平衡2NO2 (g)⇌N2O4 (g)向正反应方向移动
B.可根据现象判断NH4NO3晶体溶于水吸热,CaO固体溶于水放热
C.甲瓶中反应的化学平衡常数(K)增大
D.乙瓶中由于反应的化学平衡常数(K)改变,使Qc<K,平衡发生移动
难度: 中等查看答案及解析
-
下列图示的实验操作,不能实现相应实验目的的是
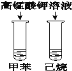
A.鉴别甲苯与己烷
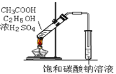
B.实验室制备乙酸乙酯
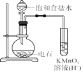
C.检验电石与饱和食盐水的产物乙炔
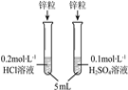
D. 比较乙酸、碳酸与苯酚酸性强弱

A.A B.B C.C D.D
难度: 中等查看答案及解析

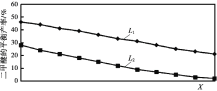
 )随温度变化如下图。
)随温度变化如下图。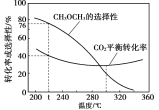
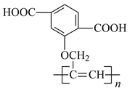 的单体R和PBT树脂的合成路线如下:
的单体R和PBT树脂的合成路线如下: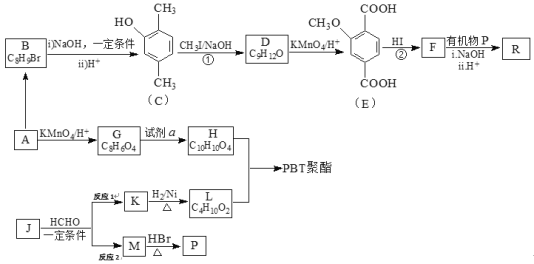
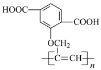 下列说法正确的是(__________)
下列说法正确的是(__________)