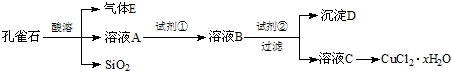
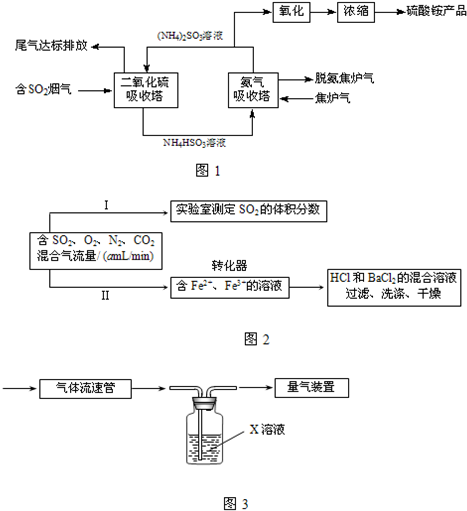
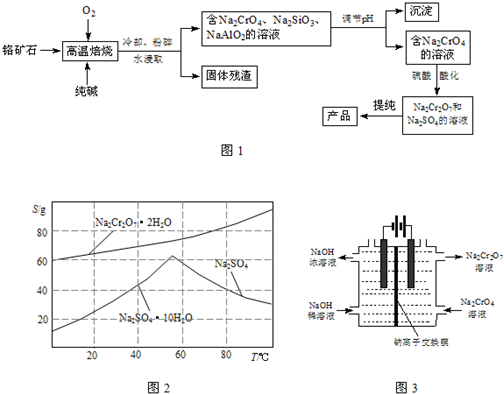
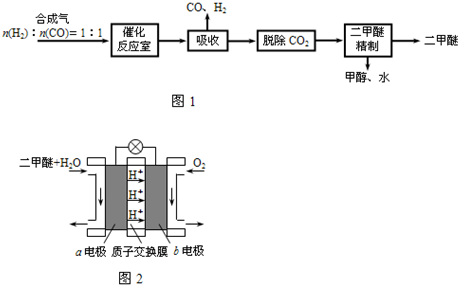
-
第十九届“世界水日”的主题是“城市用水:应对都市化挑战”.下列有关水的说法错误的是( )
A.推广使用无磷洗衣粉主要是为了防止水体富营养化
B.自来水厂利用氯气消毒,可有效杀除水中的病菌
C.明矾净水主要利用了其水解产物氢氧化铝胶体的吸附作用
D.废旧电池必须回收主要是因为电池中的NH4Cl溶于水呈碱性难度: 中等查看答案及解析
-
下列有关化学用语表示正确的是( )
A.NH4Cl的电子式:
B.中子数为7的碳原子:7C
C.Cl-的离子结构示意图:
D.次氯酸的结构式:H-Cl-O难度: 中等查看答案及解析
-
下列有关物质性质和该性质应用的说法均正确的是( )
A.常温下浓硫酸与铝不反应,可在常温下用铝制贮罐贮运浓硫酸
B.常温下二氧化硅不与任何酸反应,可用石英容器盛放氢氟酸
C.铜的金属活泼性比铁的差,可在铁船闸上装若干铜块以减缓其腐蚀
D.氧化铝熔点很高,可用作制造高温耐火材料,如制耐火砖、坩埚等难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.澄清透明的溶液中:Cu2+、Mg2+、SO、Cl-
B.由水电离出c(OH-)=1×10-12mol•L-1的溶液中:K+、HCO、Na+、Cl-
C.含有0.1 mol•L-1Fe2+的溶液中:NH、SO
、H+、NO
D.pH=10的溶液中:Al3+、Na+、Cl-、NO3-难度: 中等查看答案及解析
-
海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程.

下列有关说法正确的是( )
A.制取NaHCO3的反应是利用其溶解度小于NaCl
B.用澄清的石灰水可鉴别NaHCO3和Na2CO3
C.在工段③、④、⑤中,溴元素均被氧化
D.工业上通过电解饱和MgCl2溶液制取金属镁难度: 中等查看答案及解析
-
下列表示对应化学反应的离子方程式正确的是( )
A.氯化铝溶液中加入过量氨水:Al3++4NH3•H2O=AlO+4NH
+2H2O
B.过氧化钠与水反应制备氧气:Na2O2+H2O=2Na++2OH-+O2↑
C.硫酸亚铁溶液被空气中氧气氧化:4Fe2++O2+2H2O=4Fe3++4OH-
D.“84消毒液”(含NaClO)和“洁厕灵”(含盐酸)混合:ClO-+Cl-+2H+=Cl2↑+H2O难度: 中等查看答案及解析
-
下列有关实验原理或实验操作正确的是( )
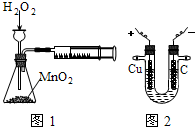
A.称取4.0gNaOH,放入100mL容量瓶中,配制1.0mol/L的NaOH溶液
B.将氯化铁固体溶于稀盐酸配制FeCl3溶液
C.利用图1装置定量测定H2O2的分解速率
D.利用图2装置模拟工业上电解饱和食盐水难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述中正确的是( )
A.1L1mol•L-1的Na2CO3溶液中含有的CO32-数目为NA
B.标准状况下,1.8gH2O所含有的电子数为NA
C.25℃时,pH=13的 Ba(OH)2溶液中含有的OH-数目为0.1 NA
D.常温常压下,2.24L 氯气与过量的氢氧化钠溶液完全反应转移的电子数为0.1NA难度: 中等查看答案及解析
-
化学中常用图象直观地描述化学反应的进程或结果(提示:FeBr2溶液中通入Cl2时,Cl2优先氧化Fe2+).下列图象描述正确的是( )
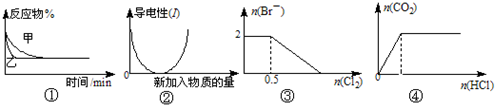
A.图①表示压强对可逆反应2A(g)+2B(g)⇌3C(g)+D(s)的影响,乙的压强大
B.图②表示乙酸溶液中通入氨气至过量的过程中溶液导电性的变化
C.图③表示在1L1mol•L-1FeBr2溶液中通入Cl2时Br-的量的变化
D.图④表示一定浓度Na2CO3溶液中滴加盐酸,生成CO2与滴加盐酸的物质的量的关系难度: 中等查看答案及解析
-
X、Y、Z、W、R是5种短周期元素,其原子序数依次增大.X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等.下列说法正确的是( )
A.W的单质不能与X、Y、Z形成的化合物反应
B.与元素X形成化合物的热稳定性:Y>R
C.元素W、R的最高价氧化物的水化物都是强酸
D.元素Y、Z、W具有相同电子层结构的离子,其半径依次增大难度: 中等查看答案及解析
-
下列说法正确的是( )
A.在一定条件下,氨气可将NO2转化成无毒的物质,是因为氨气具有还原性
B.CO2(g)+C(s)⇌2CO(g)△H>0,该反应一定不能自发进行
C.一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率
D.向2.0 mL浓度均为0.1 mol•L-1的KCl、KI混合溶液中滴加1~2滴0.01 mol•L-1AgNO3溶液,振荡,沉淀呈黄色,说明Ksp(AgI)<Ksp(AgCl)难度: 中等查看答案及解析
-
下列有关实验原理、方法和结论都正确都是( )
A.向某FeCl3溶液中加入KSCN溶液,观察到溶液呈血红色,说明该FeCl3溶液中不含Fe2+离子
B.先用水将pH试纸湿润,再测量某未知溶液的pH,若pH=1,说明该溶液中c(H+)=0.1mol•L-1
C.在0.1mol•L-1 Na2CO3溶液中,加两滴酚酞显浅红色,微热后红色加深,说明盐类水解反应是吸热反应
D.等体积、pH都为3的酸HA和HB分别与足量的锌反应,HA放出的氢气多,说明酸性:HA>HB难度: 中等查看答案及解析
-
25℃时,下列有关电解质溶液中微粒的物质的量浓度关系正确的是( )
A.在0.1mol•L-1 NaHCO3溶液中:c(HCO3-)>c(Na+)>c(CO32-)>c(H2CO3)
B.pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
C.在0.1 mol•L-1Na2CO3溶液中:c(OH-)=c(HCO3-)+2c(H2CO3)+c(H+)
D.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3)难度: 中等查看答案及解析
-
镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用.已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd+2NiOOH+2H2O
Cd(OH)2+2Ni(OH)2有关该电池的说法正确的是( )
A.放电时负极得电子,质量减轻
B.放电时电解质溶液中的OH-向负极移动
C.充电时阴极附近溶液的pH减小
D.充电时阳极反应:Ni(OH)2-e-+OH-=NiOOH+H2O难度: 中等查看答案及解析
-
某密闭容器中,加入一定量的X和Y,发生如下反应:2X+Y⇌2Z.不同温度时,产物Z的生成情况如右图所示,a为T1℃时的情况,b为T2℃时的情况,c为T2℃时从时间t3开始加压的情况,下列叙述正确的是( )

A.反应“2X+Y⇌2Z”的△H<0
B.Z一定为气体,X一定为非气体
C.升高温度,化学平衡向正反应方向移动
D.若t2~t3段平衡常数为K1,t4后平衡常数为K2,则K1>K2难度: 中等查看答案及解析