-
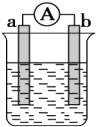
把甲、乙、丙、丁四块金属泡在稀H2SO4中,用导线两两相连可以组成各种原电池。若甲、乙相连,甲为负极;丙、丁相连,丁上有气泡逸出;甲、丙相连,甲上发生氧化反应;乙、丁相连,乙是电子流入的一极。则四种一金属的活动性顺序由大到小排列为
A. 甲>丙>丁>乙 B. 甲>丙>乙>丁
C. 甲>乙>丙>丁 D. 乙>丁>丙>甲
难度: 简单查看答案及解析
-
几种短周期元素的原子半径及主要化合价如表所示:( )
元素符号
X
Y
Z
R
T
原子半径(nm)
0.160
0.080
0.102
0.143
0.074
主要化合价
+2
+2
-2,+4,+6
+3
-2
根据表中信息,判断以下说法正确的是( )
A. 单质与氢气化合的难易程度Z>T
B. 离子半径:T2- > X2+ > R3+
C. 元素最高价氧化物对应水化物的碱性:Y>R>X
D. 相同条件下,单质与稀硫酸反应的剧烈程度:R>Y>X
难度: 中等查看答案及解析
-
下列变化中,反应物的总能量小于生成物的总能量的是( )
A. 过氧化氢分解 B. 铝热反应 C. 碳酸钙分解 D. 酸碱中和
难度: 简单查看答案及解析
-
研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,下列“水” 电池在海水中放电时的有关说法正确的是( )
A.正极反应式:Ag+Cl--e-=AgCl B.每生成1 mol Na2Mn5O10转移2 mol电子
C.Na+不断向“水”电池的负极移动 D.AgCl是还原产物
难度: 中等查看答案及解析
-
钠和铯都是碱金属元素,下列关于铯及其化合物的叙述中正确的是
A. 铯的密度比水小,像钠一样浮在水面上
B. 铯与水反应十分剧烈,甚至会发生爆炸
C. 碳酸铯加热时易分解成二氧化碳和氧化铯
D. 氢氧化铯是强碱,其碱性比氢氧化钾弱
难度: 简单查看答案及解析
-
氢氧燃料电池已用于航天飞机,其工作原理如图所示。关于该燃料电池的说法不正确的是
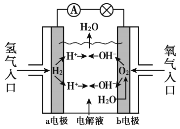
A. H2在负极发生氧化反应
B. 电子从a电极经外电路流向b电极
C. 供电时的总反应为:2H2 + O2 == 2H2O
D. 燃料电池的能量转化率可达100%
难度: 中等查看答案及解析
-
某种碱性氢氧燃料电池的正极反应式为:O2+4e-+2H2O = 4OH-。下列有关该电池的叙述正确的是( )
A.工作时,电解质溶液中的OH-向正极移动
B.工作一段时间后,电解液中KOH的物质的量浓度减小
C.负极上发生的反应为H2-2e-= 2H+
D.若电池在工作过程中有0.4 mol电子转移,则正极消耗2.24L O2
难度: 中等查看答案及解析
-
下图是铜锌原电池示意图。图2中,x轴表示实验时流入正极的电子的物质的量,y轴表示( )
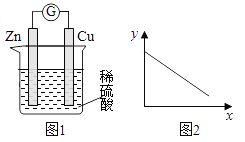
A.c(H+) B.V(H2) C.m(溶液) D.m(Cu)
难度: 中等查看答案及解析
-
下列各个装置中能组成原电池的是
A.
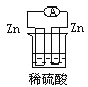 B.
B.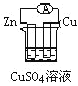
C.
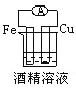 D.
D.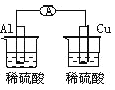
难度: 中等查看答案及解析
-
有人设计出利用CH4和O2的反应,用铂电极在KOH溶液中构成原电池,电池的总反应类似于CH4在O2中燃烧,则下列说法正确的是( )
①每消耗1mol CH4,可以向外电路提供约
的电量;
②负极上CH4失去电子,电极反应式为: CH4-8e-+10OH—=CO32-+7H2O
③负极上是O2获得电子,电极反应式为
;
④电池放电后,溶液pH不断升高
A.①② B.①③ C.①④ D.③④
难度: 简单查看答案及解析
-
下列有关铝热反应的说法中,不正确的是
A. 利用了铝的还原性
B. 可用于焊接铁轨,反应为2Al + Fe2O3
Al2O3 + 2Fe
C. 可用于冶炼某些高熔点金属
D. 能量变化可用如图表示
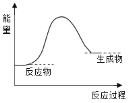
难度: 简单查看答案及解析
-
已知反应A+B= C+D的能量变化如下图所示,下列说法正确的是
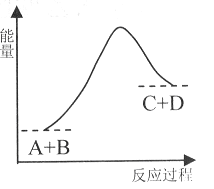
A.该反应是放热反应
B.只有在加热条件下才能进行
C.反应物的总能量高于生成物的总能量
D.反应中断开化学键吸收的总能量高于形成化学键放出的总能量
难度: 简单查看答案及解析
-
中国科学院科研团队研究表明,在常温常压和可见光下,基于LDH(一种固体催化剂)合成NH3的原理示意图如下。下列说法不正确的是( )
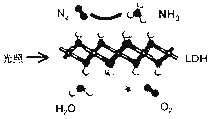
A.该过程将太阳能转化成为化学能 B.该过程中,涉及极性键与非极性键的断裂与生成
C.氧化产物与还原产物的物质的量之比为3∶4 D.该反应为放热反应
难度: 中等查看答案及解析
-
如图所示,有关化学反应和能量变化的说法正确的是( )
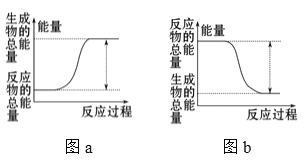
A.图a表示的是吸热反应的能量变化
B.图a一定需要加热才能发生,图b不加热也能发生
C.图b中反应物比生成物稳定
D.图b可以表示氯化铵固体与氢氧化钡晶体反应的能量变化
难度: 中等查看答案及解析
-
下列实验现象或图像信息不能充分说明相应的化学反应是放热反应的是( )
反应装置或图像
实验现象或图像信息
A

反应开始后,针筒活塞向右移动
B
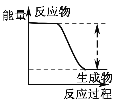
反应物总能量大于生成物总能量
C
反应开始后,甲处液面低于乙处液面
D
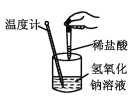
温度计的水银柱不断上升
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列说法不正确的是
A. 需要加热才能发生的反应不一定是吸热反应
B. 反应物和生成物具有的总能量决定了反应是吸热还是放热
C. 在化学反应过程中,发生物质变化的同时不一定发生能量变化
D. 将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中,然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固。由此可知,在该反应中反应物的总能量低于生成物的总能量
难度: 中等查看答案及解析
-
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法不正确的是( )
A. Q、W、Y对应的氢化物的沸点逐渐降低
B. 阴离子的还原性:W2->Q-
C. 离子半径:Y2->Z3+
D. 元素的非金属性:Y>W
难度: 简单查看答案及解析
-
科学家根据元素周期律和原子结构理论预测,原子序数为114的元素位于第七周期ⅣA族,称为类铅元素。下面关于它的原子结构和性质预测正确的是
A. 类铅元素原子的最外层电子数为6
B. 它的最高价氧化物水化物的碱性比铅的最高价氧化物水化物的碱性弱
C. 它的金属性比铅强
D. 它的原子半径比铅小
难度: 困难查看答案及解析
-
下列有关原子结构和元素周期律表述正确的是
①稀有气体不活泼是因为它们原子最外层都已达到8电子稳定结构
②第ⅦA族元素是同周期中非金属性最强的元素
③第二周期第ⅣA族元素的核电荷数和中子数一定为6
④原子序数为12的元素位于元素周期表的第三周期第ⅡA族
A.①② B.①③ C.②④ D.③④
难度: 中等查看答案及解析
-
如图为发光二极管连接柠檬电池装置,下列说法正确的是( )
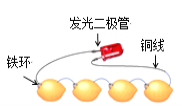
A.铁环作为柠檬电池的正极
B.电子由发光二极管经导线流向Fe环
C.负极的电极反应为:Fe-2e-=Fe2+
D.可将柠檬替换成盛装酒精溶液的装置
难度: 中等查看答案及解析