-
几种短周期元素的原子半径及主要化合价如表:
元素
X
Y
Z
W
原子半径/pm
186
143
75
71
主要化合价
+1
+3
+5、+3、-3
-1
下列叙述正确的是( )
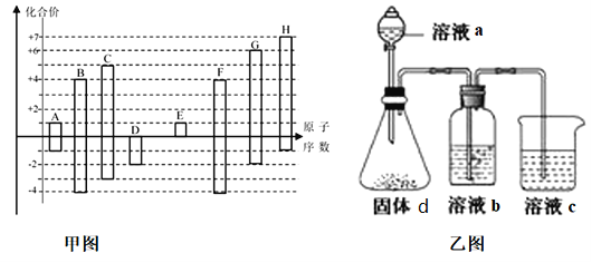
A.X、Y元素的金属性X<Y
B.Z的气态氢化物比W的气态氢化物稳定
C.Y的最高价氧化物对应的水化物能溶于稀氨水
D.四种元素对应的简单离子的离子半径大小顺序为Z3->W->X+>Y3+
难度: 困难查看答案及解析
-
下列每组中各物质内既有离子键又有共价键的一组是
A.Na2O2、KOH、Na2SO4 B.MgO、Na2SO4、NH4HCO3
C.NaOH、H2SO4、(NH4)2SO4 D.HCl、Al2O3、MgCl2
难度: 中等查看答案及解析
-
下列变化中,不需要破坏化学键的是
A.氯化氢溶于水 B.加热氯酸钾使其分解
C.碘升华 D.氯化钠溶于水
难度: 简单查看答案及解析
-
俄罗斯科学家用铪和钨两种核素精确确定了地球和月球的年龄,得出月球至少比地球早700万年形成,它们是根据18272Hf(铪-182)和18274W(钨-182)两种核素的含量比例得出的。下列有关铪-182和钨-182的关系说法正确的是( )
A.中子数相等 B.互为同位素
C.原子质量几乎相同 D.在周期表中处于相邻位置
难度: 中等查看答案及解析
-
下列化学用语表达正确的是( )
A.质量数之和是质子数之和两倍的水分子符号可能是
B.Mg的原子结构示意图为
C.次氯酸的电子式为
D.氮气分子的结构式: N2
难度: 简单查看答案及解析
-
下列各组中属于同位素关系的是
A.
与
B. T2O与H2O C.
与
D. 金刚石与石墨
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.周期表中第四周期共有32种元素
B.原子最外层电子只有一个1个或2个的元素一定是金属元素
C.X2+的核外电子数目为18,则X在第四周期ⅡA族
D.根据元素周期表的排布原则,第47号元素位于第五周期第ⅡB族
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.18gH2O中含有的中子数为10NA
B.同一元素的核素种类数由中子数决定
C.质子数相同的微粒一定属于同一种元素
D.通过化学变化可以实现
与
之间的相互转化
难度: 中等查看答案及解析
-
应用元素周期律分析下列推断,其中正确的组合是( )
①碱金属单质的熔点随原子序数的增大而降低
②砹(At)是第ⅦA族元素,其氢化物的稳定大于HCl
③磷(P)的最高价氧化物对应的水化物的酸性比硫酸弱
④第二周期非金属元素的气态氢化物溶于水后,水溶液均为酸性
⑤铊(Tl)与铝同主族,其氢氧化物既能与盐酸反应,又能与氢氧化钠溶液反应
⑥第三周期金属元素的最高价氧化物对应水化物,其碱性随原子序数的增大而减弱
A.①③④ B.①③⑥ C.③④⑤ D.②④⑥
难度: 中等查看答案及解析
-
下列说法正确的是( )
离子化合物含离子键,也可能含极性键或非极性键
硫酸的酸性大于碳酸的酸性,所以非金属性
含金属元素的化合物不一定是离子化合物
由非金属元素组成的化合物一定是共价化合物
熔融状态能导电的化合物是离子化合物
由分子组成的物质中一定存在共价键
A.
B.
C.
D.
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W原子序数依次增大,X原子核外有9个电子,Y原子最外层电子数是最内层电子数的一半,Z最高正价是最低负价绝对值的3倍。下列叙述正确的是( )
A. 原子半径:W<X<Y<Z
B. 化合物Y2Z中既有离子键、又有共价键
C. Y、W最高价氧化物对应水化物的溶液均能溶解氧化铝
D. 简单气态氢化物的稳定性由强到弱的顺序:Z、W、X
难度: 中等查看答案及解析
-
短周期主族元素W、X、Y、Z的原子序数依次增加。W和Y同主族,X和Z同主族,W与X形成的二元化合物有两种,常温下均是液体;Y与Z的电子层数相同;向过量的YWZ溶液中滴入少量胆矾溶液,观察到既有黑色沉淀生成又有臭鸡蛋气味的气体放出。下列说法正确的是( )
A.YWZ是共价化合物
B.最简单气态氢化物的沸点:X>Z
C.原子半径由小到大的顺序为:r(W)<r(X)<r(Y)<r(Z)
D.简单离子的氧化性:W<Y
难度: 中等查看答案及解析
-
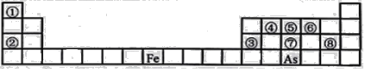
今年是门捷列夫发现元素周期律151周年。下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法错误的是( )
A.常温常压下,Y单质为固态
B.气态氢化物热稳定性:Z<W
C.原子半径:W<X
D.X的最高价氧化物的水化物是强碱
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A.在周期表中金属与非金属交界处可找到半导体材料
B.从上到下,卤素的单质熔沸点逐渐升高
C.从上到下,卤素单质颜色逐渐加深,与氢气的化合越来越难,单质氧化性逐渐减弱
D.从上到下,卤素的非金属性越来越弱,所以氢化物的水溶液的酸性越来越弱
难度: 简单查看答案及解析
-
下列说法中正确的是( )
A.在蔗糖中加入浓H2SO4后出现发黑现象,说明浓硫酸具有吸水性
B.浓硝酸保存在棕色的细口瓶中,并置于低温阴暗处
C.氨经催化氧化起到了氮的固定作用
D.正常雨水pH等于7,酸雨的pH小于7
难度: 中等查看答案及解析
-
已知下列四组实验,现象和结论均正确的是( )
操作
现象
结论
A
滴加稀NaOH溶液,将红色石蕊试纸置于试管口
试纸不变蓝
原溶液中无NH
B
将SO2通入Ba(NO3)2溶液中
出现白色沉淀
沉淀为BaSO3
C
在Na2S溶液中滴加新制氯水
产生浅黄色沉淀
非金属性:C1>S
D
将稀硝酸加入过量铁粉中,充分反应后,滴加KSCN溶液
有气体生成,溶液呈血红色
稀硝酸将Fe氧化成Fe3+
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
“封管实验”具有简易、方便、节约、绿色等优点,下列关于三个“封管实验”(夹持装置未画出)的说法正确的是( )
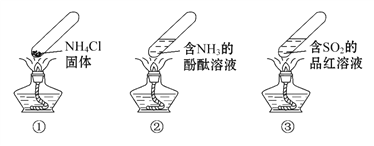
A.加热时,①中上部汇集了NH4Cl固体
B.加热时,②中溶液变红,冷却后又都变为无色
C.加热时,③中溶液红色褪去,冷却后溶液变红,体现SO2的漂白性
D.三个“封管实验”中所发生的化学反应都是可逆反应
难度: 中等查看答案及解析
-
NA代表阿伏加德罗常数的值,以下说法正确的是( )
A.将足量Zn与100mL18mol/L 浓硫酸反应,生成224mL气体,转移电子为0.02NA
B.32gCu将足量浓、稀硝酸分别还原为NO2和NO,浓、稀硝酸得到的电子数均为NA
C.1 mol Na2O2固体中含离子总数与1 mol CH4中所含共价键数目相等
D.常温常压下,92 g的NO2和N2O4混合气体中含有的氮原子数为3NA
难度: 中等查看答案及解析
-
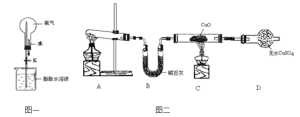
碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是( )
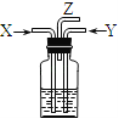
A.洗气瓶中产生的沉淀是碳酸钡
B.洗气瓶中产生的沉淀是硫酸钡
C.在Z导管出来的气体中没有二氧化碳
D.在Z导管口排出无色气体
难度: 中等查看答案及解析
-
将质量为mg的铜屑完全溶于适量浓硝酸中,反应后得到NO2、NO的混合气体,将所得气体通入300mL2mol•L-1NaOH溶液中,恰好完全反应,生成含NaNO3和NaNO2的盐溶液,其中NaNO3的物质的量为0.2mol,则m的值为( )
A.12.8 B.19.2 C.25.6 D.51.2
难度: 中等查看答案及解析