-
用黄色的FeCl3溶液分别进行下列实验,解释或结论不正确的是 ( )。
选项
实验
现象
解释或结论
A
加入FeCl3固体
溶液变成红褐色
FeCl3的水解程度变大
B
加入等体积水
溶液颜色变浅
c(Fe3+)变小
C
加入足量Fe粉
溶液颜色变成浅绿色
2Fe3++Fe=3Fe2+
D
将FeCl3溶液微热
溶液变成红褐色
水解反应ΔH>0
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列分别是利用不同能源发电的实例,其中不属于新能源开发利用的是( )
A.
 风力发电 B.
风力发电 B.  太阳能发电
太阳能发电C.
 火力发电 D.
火力发电 D.  潮汐能发电
潮汐能发电难度: 简单查看答案及解析
-
下列化学用语对事实的表述不正确的是( )
A.电解精炼铜的阴极反应:Cu2+ +2e−=Cu
B.常温时,0.1mol/L氨水的pH=11.1:NH3·H2O⇌
+OH−
C.醋酸钠使酚酞溶液变红:CH3COONa+H2O=CH3COOH+NaOH
D.由Na和Cl形成离子键的过程:

难度: 简单查看答案及解析
-
用铂电极电解一定浓度的下列物质的水溶液,在电解后的电解液中加适量水,就能使溶液浓度恢复到电解前浓度的是( )
A.AgNO3 B.K2S C.Na2CO3 D.CuSO4
难度: 简单查看答案及解析
-
镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd+2NiOOH+2H2O
Cd(OH)2+2Ni(OH)2。有关该电池的说法正确的是( )
A.放电时负极得电子,质量减轻
B.放电时负极附近的pH增大
C.充电时该电池的正极与外加电源的负极相连
D.充电时阳极反应:Ni(OH)2-e-+OH-=NiOOH+H2O
难度: 简单查看答案及解析
-
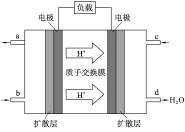
下图是利用盐桥电池从某些含碘物质中提取碘的两个装置
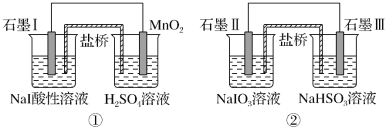
下列说法中正确的是( )
A.两个装置中,石墨I和石墨Ⅱ均作负极
B.碘元素在装置①中被还原,在装置②中被氧化
C.装置①、②中的反应生成等量的I2时,导线上通过的电子数之比为1∶5
D.装置①中MnO2的电极反应式为MnO2+2H2O+2e-=Mn2++4OH-
难度: 简单查看答案及解析
-
中国生产的首艘国产航母“山东”号已经下水。为保护航母、延长服役寿命可采用两种电化学方法。方法1:舰体镶嵌一些金属块;方法2:航母舰体与电源相连。下列有关说法正确的是( )
A.方法1中金属块可能是锌、锡和铜 B.方法2中舰体连接电源的负极
C.方法1叫外加电流的阴极保护法 D.方法2叫牺牲阳极的阴极保护法
难度: 简单查看答案及解析
-
气体A、B分别为0.6 mol和0.5 mol,在0.4 L密闭容器中发生反应:3A+B⇌aC+2D,经5 min后,此时C为0.2mol,又知在此反应时间内,D的平均反应速率为0.1 mol·(L·min)-1,下列结论正确的是( )
A.A的平均反应速率为0.1 mol·(L·min)-1 B.a值为2
C.B的转化率为50% D.此时,反应混合物总的物质的量为1 mol
难度: 中等查看答案及解析
-
在一定温度下,10mL0.40mol/L H2O2发生催化分解。不同时刻测定生成O2的体积(已折算为标准状况)如下表。
t/min
0
2
4
6
8
10
V(O2)/mL
0.0
9.9
17.2
22.4
26.5
29.9
下列叙述不正确的是(溶液体积变化忽略不计)
A.0~6min的平均反应速率:v(H2O2)
mol/(L·min)
B.6~10min的平均反应速率:v(H2O2)<
mol/(L·min)
C.反应至6min时,c(H2O2)=0.3mol/L
D.反应至6min时,H2O2分解了50%
难度: 简单查看答案及解析
-
在一定条件下,固定容积的密闭容器中反应:2NO2(g)⇌O2(g)+2NO(g) ΔH>0,达到平衡。当改变其中一个条件X,Y随X的变化符合图中曲线的是( )
A.当X表示温度时,Y表示NO2的物质的量
B.当X表示压强时,Y表示NO2的百分含量
C.当X表示反应时间时,Y表示混合气体的密度
D.当X表示NO2的物质的量时,Y表示O2的物质的量
难度: 简单查看答案及解析
-
在恒容密闭容器中,CO与H2发生反应CO(g)+2H2(g)⇌CH3OH(g) ΔH<0,达到平衡后,若只改变某一条件,下列示意图正确的是( )
A.
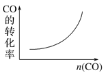 B.
B.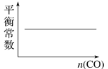 C.
C.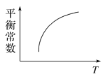 D.
D.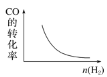
难度: 简单查看答案及解析
-
下列说法中正确的是( )
A.显酸性的溶液是酸溶液,显碱性的溶液是碱溶液
B.盐促进水的电离,酸碱抑制水的电离
C.常温下,某溶液中水电离出的H+浓度为1×10-9 mol/L,该溶液不一定是碱溶液
D.中性溶液即pH=7的溶液
难度: 简单查看答案及解析
-
25 ℃时,下列溶液的酸性最强的是( )
A.0.01 mol/L的HCl溶液 B.pH=2的H2SO4溶液
C.c(OH-)=10-13 mol/L的溶液 D.pH=1的HNO3溶液加水稀释为原来的2倍
难度: 简单查看答案及解析
-
在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系。下列说法正确的是( )
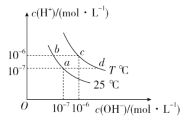
A.c点对应的溶液pH=6,显酸性 B.T℃ 下,水的离子积常数为1×10-12
C.T<25℃ D.纯水仅升高温度,可以从a点变到d
难度: 简单查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.由水电离出的H+浓度为1×10-9 mol/L的溶液中:Al3+、
、Na+、Cl-
B.遇酚酞变红的溶液中:
、Na+、
、K+
C.c(
)=1mol/L的溶液中:H+、Fe2+、Cl-、
D.pH=1的溶液中:
、
、K+、Cl-
难度: 简单查看答案及解析
-
现有0.1mol·L-1氨水10mL,加蒸馏水稀释到1L后,下列变化中正确的是( )
①电离程度增大②[NH3·H2O]增大③
数目增多④[OH-]增大⑤导电性增强⑥
增大⑦
减小
A.①②③ B.①③⑤ C.①③⑥ D.②④⑥
难度: 简单查看答案及解析
-
相同温度下,三种酸的电离常数如表,下列判断正确的是( )
酸
HX
HY
HZ
电离常数Ka
9×10-7 mol/L
9×10-6 mol/L
2×10-2 mol/L
A.相同温度下,1mol/LHX溶液的电离常数大于0.1mol/LHX
B.相同温度下,0.1mol/L的NaX、NaY、NaZ溶液,NaZ溶液pH最大
C.反应HZ+Y-= HY+Z-能够发生
D.三种酸的酸性强弱关系:HX>HY>HZ
难度: 简单查看答案及解析
-
常温下,将pH=9和pH=11的两种强碱溶液等体积混合,则混合溶液的pH为( )
A.10.7 B.9.3 C.10 D.无法确定
难度: 简单查看答案及解析