-
下列物质中,属于强电解质的是( )
A.CO2
B.NaOH溶液
C.NH3•H2O
D.HCl难度: 中等查看答案及解析
-
0.1mol•L-1的下列物质的水溶液中,氢离子浓度最大的是( )
A.NH3•H2O
B.NH4Cl
C.HCl
D.CH3COOH难度: 中等查看答案及解析
-
升高温度,下列数据不一定增大的是( )
A.化学反应速率v
B.KNO3的溶解度S
C.化学平衡常数K
D.水的离子积常数KW难度: 中等查看答案及解析
-
下列过程表达式中,属于电离方程式的是( )
A.NCO+H2O⇌H2CO3+OH-
B.NH3.H2O⇌NH+OH-
C.NH3+H+=NH
D.HCO+OH-=H2O+CO
难度: 中等查看答案及解析
-
下列式子中,属于水解反应的是( )
A.H2O+H2O⇌H3O++OH-
B.CO32-+H2O⇌HCO3-+OH-
C.NH3+H2O⇌NH3•H2O
D.HCO3-+OH-⇌H2O+CO32-难度: 中等查看答案及解析
-
已知;(NH4)2CO3(s)═NH4HCO3(s)+NH3(g)△H=+74.9kJ•mol-1,下列说法中正确的是( )
A.该反应中熵变、焓变皆大于0
B.该反应是吸热反应,因此一定不能自发进行
C.碳酸盐分解反应中熵增加,因此任何条件下所有碳酸盐分解一定自发进行
D.能自发进行的反应一定是放热反应,不能自发进行的反应一定是吸热反应难度: 中等查看答案及解析
-
恒温密闭容器中,某反应的化学反应速率随时间变化关系如图所示,下列说法不符合该图示的是( )

A.达到平衡时,正逆反应速率相等
B.增大反应物的浓度,反应由平衡I变化到平衡II
C.反应达到平衡I以后,减小反应物浓度,平衡移动到II
D.反应达到平衡II时的化学反应速率比平衡I时的大难度: 中等查看答案及解析
-
常温下pH均为2的两种酸溶液X和Y各10mL分别加水稀释到10000mL,其pH与所加水的体积变化如图所示,下列结论中正确的是( )

A.加水后,Y酸的电离度增大
B.X酸在水溶液中存在电离平衡
C.加水后,X酸的电离平衡常数减小
D.X酸的物质的量浓度与Y酸的物质的量浓度相等难度: 中等查看答案及解析
-
在下列的各种叙述中,正确的是( )
A.在任何条件下,纯水的pH=7
B.在任何条件下,纯水都呈中性
C.在100℃时,纯水的pH>7
D.在100℃时,纯水中c(H+)<10-7mol/L难度: 中等查看答案及解析
-
在0.1mol•L-1 CH3COOH溶液中存在如下电离平衡:CH3COOH⇌CH3COO-+H+对于该平衡,下列叙述正确的是( )
A.加入水时,平衡向逆反应方向移动
B.加入少量NaOH固体,平衡向正反应方向移动
C.加入少量0.1mol•L-1 HCl溶液,平衡向正反应方向移动
D.加入少量CH3COONa固体,平衡向正反应方向移动难度: 中等查看答案及解析
-
在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ,下列热化学方程式正确的是( )
A.CH3OH(l)+O2(g)═CO2(g)+2H2O(l)△H=+725.8kJ/mol
B.2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=-1452kJ/mol
C.2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=-725.8kJ/mol
D.2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=+1452kJ/mol难度: 中等查看答案及解析
-
对于:2C4H10(g)+13O2(g)═8CO2(g)+10H2O(l);△H=-5800kJ/mol的叙述不正确的是( )
A.该反应的反应热为△H=-5800kJ/mol,是放热反应
B.该反应的△H与各物质的状态有关,与化学计量数也有关
C.该式的含义为:25℃、101kPa下,2molC4H10气体完全燃烧生成CO2和液态水时放出热量5800kJ
D.该反应为丁烷燃烧的热化学方程式,由此可知丁烷的燃烧热为5800kJ/mol难度: 中等查看答案及解析
-
某学生的实验报告所列出的下列数据中合理的是( )
A.用10mL量筒量取7.13mL稀盐酸
B.用托盘天平称量25.20gNaCl
C.用广泛pH试纸测得某溶液的pH为2.3
D.用25mL滴定管做中和滴定时,用去某浓度的碱溶液21.70mL难度: 中等查看答案及解析
-
为了除去MgCl2溶液中的FeCl3,可在加热搅拌的条件下加入的一种试剂是( )
A.NaOH
B.MgO
C.氨水
D.铁粉难度: 中等查看答案及解析
-
在下列各溶液中,离子一定能大量共存的是( )
A.强碱性溶液中:K+、Mg2+、Cl-、
B.室温下,pH=1的盐酸中:Na+、Fe3+、、
C.含有Ca2+的溶液中:Na+、K+、、Cl-
D.由水电离产生的c(H+)=1×10-13mol/L的溶液中:Na+、K+、Cl-、难度: 中等查看答案及解析
-
25℃时,水中存在电离平衡:H2O⇌H++OH-△H>0.下列叙述正确的是( )
A.将水加热,Kw增大,pH不变
B.向水中加入少量NaHSO4固体,c(H+)增大,Kw不变
C.向水中加入少量NaOH固体,平衡逆向移动,c(OH-)降低
D.向水中加入少量NH4Cl固体,平衡正向移动,c(OH-)增大难度: 中等查看答案及解析
-
下列事实不能说明HClO是弱电解质的是( )
A.常温下NaClO溶液的pH大于7
B.常温下0.1mol•L-1的HClO溶液的pH为2.1
C.pH=11的NaClO溶液加水稀释到100倍,pH大于9
D.用HClO溶液作导电实验,灯泡很暗难度: 中等查看答案及解析
-
在室温下,下列叙述正确的是( )
A.将1mLpH=3的一元酸溶液稀释到10mL,若溶液的pH<4,则此酸为弱酸
B.将1mL1.0×10-5mol/L盐酸稀释到1000mL,得到pH=8的盐酸
C.用pH=1的盐酸分别中和1mLpH=13NaOH溶液和氨水,NaOH消耗盐酸的体积大
D.pH=2的盐酸与pH=1的硫酸比较,c(Cl-)=c(SO)
难度: 中等查看答案及解析
-
常温下,浓度均为0.1mol/L的三种溶液:①CH3COOH溶液、②NaOH溶液、③CH3COONa溶液.下列说法不正确的是( )
A.溶液的pH:②>③>①
B.水电离出的c(OH-):③>①>②
C.②和③等体积混合后的溶液:c(Na+)+c(H-)=c(OH-)+c(CH3COO-)
D.①和②等体积混合后的溶液:c(CH3COOH)+c(CH3COO)=0.1mol/L难度: 中等查看答案及解析
-
某同学在三个容积相同的密闭容器中,研究三种不同条件下化学反应2X(g)⇌Y(g)+W(g)的进行情况,其中实验Ⅰ、Ⅱ控温在T1,实验Ⅲ控温在T2,它们的起始浓度均是c(X)=1.0mol•L-1,c(Y)=c(W)=0,测得反应物X的浓度随时间的变化如图所示,下列说法不正确的是( )
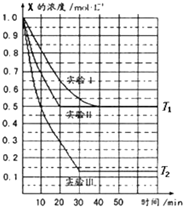
A.与实验Ⅰ相比,实验Ⅱ可能使用了催化剂
B.与实验Ⅰ相比,实验Ⅲ若只改变温度,则温度T1<T2,该反应是吸热反应
C.在实验Ⅰ、Ⅱ、Ⅲ中,达到平衡状态时X的体积百分含量相同
D.若起始浓度c(X)=0.8mol•L-1,c(Y)=c(W)=0,其余条件与实验I相同,则平衡浓度c(X)=0.4mol•L-1难度: 中等查看答案及解析