-
通过以下反应均可获取H2。下列有关说法正确的是( )
①太阳光催化分解水制氢:2H2O(l)=2H2(g)+ O2(g) ΔH1=+571.6 kJ·mol-1
②焦炭与水反应制氢:C(s)+ H2O(g)=CO(g)+ H2(g) ΔH2=+131.3 kJ·mol-1
③甲烷与水反应制氢:CH4(g)+ H2O(g)=CO(g)+3H2(g) ΔH3=+206.1 kJ·mol-1
A.反应①中电能转化为化学能
B.反应②为放热反应
C.反应③使用催化剂,ΔH3减小
D.反应CH4(g)=C(s)+2H2(g)的ΔH=+74.8 kJ·mol-1
难度: 中等查看答案及解析
-
a、b、c、d为短周期元素,a的原子中只有1个电子,b2−和C+离子的电子层结构相同,d与b同族。下列叙述错误的是
A.a与其他三种元素形成的二元化合物中其化合价均为+1
B.b与其他三种元素均可形成至少两种二元化合物
C.c的原子半径是这些元素中最大的
D.d和a形成的化合物的溶液呈弱酸性
难度: 中等查看答案及解析
-
化学是你,化学是我,化学深入我们生活,下列说法正确的是
A.木材纤维和土豆淀粉遇碘水均显蓝色
B.食用花生油和鸡蛋清都能发生水解反应
C.包装用材料聚乙烯和聚氯乙烯都属于烃
D.PX项目的主要产品对二甲苯属于饱和烃
难度: 简单查看答案及解析
-
230Th和232Th是钍的两种同位素,232Th可以转化成233U。下列有关Th的说法正确的是
A.Th 元素的质量数是232 B.Th 元素的相对原子质量是231
C.232Th 转换成233U是化学变化 D.230Th和232Th的化学性质相同
难度: 简单查看答案及解析
-
下列有关化学键的叙述,正确的是
A.离子化合物中一定含有离子键
B.单质分子中均不存在化学键
C.乙醇(C2H5OH)沸点高于甲醚(CH3-O-CH3),是因为化学键的强弱不同
D.含有共价键的化合物一定是共价化合物
难度: 中等查看答案及解析
-
下列设备工作时,将化学能转化为热能的是( )
A.
 硅太阳能电池 B.
硅太阳能电池 B.  锂离子电池
锂离子电池C.
 太阳能集热器 D.
太阳能集热器 D.  燃气灶
燃气灶难度: 简单查看答案及解析
-
下列四种x的溶液,分别加入盛有
盐酸的烧杯中,并加入水稀释至500mL,此时x和盐酸缓和地进行反应,其中反应速率最大的是
A. 20 mL,
B. 20 mL,
C. 10 mL,
D. 10 mL,
难度: 中等查看答案及解析
-
反应3Fe(s)+4H2O(g)=Fe3O4(s)+4H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
A.将铁片变成铁粉
B.将容器的体积缩小一半
C.保持体积不变,充入N2使容器压强增大
D.压强不变,充入N2使容器体积增大
难度: 简单查看答案及解析
-
已知:C(s)+H2O(g)=CO(g)+H2(g)△H=+130kJ·mol-1,2C(s)+O2(g)=2CO(g)△H=akJ·mol-1,H-H、O=O和O-H键的键能分别为436kJ·mol-1、496kJ·mol-1和462kJ·mol-1,则a为
A.+220 B.+704 C.-704 D.-220
难度: 简单查看答案及解析
-
某有机物的结构简式为
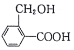 ,其可能具有的性质是①能发生加成反应②能使酸性高锰酸钾溶液褪色③能发生取代反应④能发生中和反应⑤能发生氧化反应
,其可能具有的性质是①能发生加成反应②能使酸性高锰酸钾溶液褪色③能发生取代反应④能发生中和反应⑤能发生氧化反应A.全部 B.①③④ C.①②③④ D.①②③
难度: 中等查看答案及解析
-
我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下:
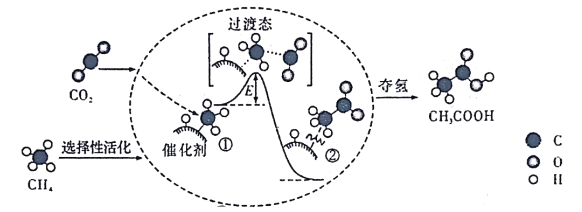 下列说法不正确的是( )
下列说法不正确的是( )A.生成CH3COOH总反应的原子利用率为100%
B.CH4→CH3COOH过程中,有C—H键发生断裂.
C.①→②过程吸收能量并形成了C—C键
D.该催化剂对该反应的平衡转化率无影响
难度: 简单查看答案及解析
-
已知:C(s)+O2(g)=CO2(g) △H1
CO2(g)+C(s)=2CO(g) △H2
2CO(g)+O2(g)=2CO2(g) △H3
4Fe(s)+3O3(g)=2Fe2O3(s) △H4
3 CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s) △H5
下列关于上述反应焓变的判断正确的是
A.△H1>0,△H3<0
B.△H2>0,△H4>0
C.△H1=△H2+△H3
D.△H3=△H4+△H5
难度: 中等查看答案及解析
-
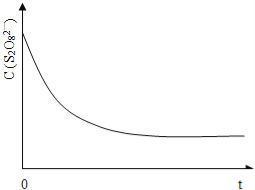
在一定温度下,10mL0.40mol/L H2O2发生催化分解。不同时刻测定生成O2的体积(已折算为标准状况)如下表。
t/min
0
2
4
6
8
10
V(O2)/mL
0.0
9.9
17.2
22.4
26.5
29.9
下列叙述不正确的是(溶液体积变化忽略不计)
A.0~6min的平均反应速率:v(H2O2)
mol/(L·min)
B.6~10min的平均反应速率:v(H2O2)<
mol/(L·min)
C.反应至6min时,c(H2O2)=0.3mol/L
D.反应至6min时,H2O2分解了50%
难度: 简单查看答案及解析