-
下列仪器在使用前不需要检漏(检查装置密封性)的是
A. 锥形瓶 B. 容量瓶
C. 分液漏斗 D. 酸(碱)式滴定管
难度: 简单查看答案及解析
-
下列说法正确的是
A. 等质量的S(g)和S(s)在氧气中充分燃烧生成SO2(g),后者放出热量多
B. 反应C(金刚石)=C(石墨) ΔH<0,说明石墨比金刚石稳定
C. 有化学键断裂的过程一定发生了化学变化
D. 保持同温同压,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同
难度: 中等查看答案及解析
-
下列热化学方程式书写正确的是
A. 已知甲烷的燃烧热为890.3 kJ‧mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3 kJ‧mol-1
B. 已知强酸和强碱的稀溶液反应的中和热为57.3 kJ‧mol-1,则CH3COOH+OH—=CH3COO—+H2O ΔH=-57.3 kJ‧mol-1
C. 一定条件下,将0.5mol N2和1.5mol H2置于密闭容器中,充分反应生成NH3(g),放出热量19.3kJ,其热化学方程式为:N2(g)+3H2(g)
2NH3(g) ΔH=-38.6 kJ‧mol-1
D. 已知1g N2H4(l)和足量H2O2(l)反应生成氮气和水蒸气,放出热量20.05kJ,该热化学方程式可表示为:N2H4(l)+2H2O2(l)=N2(g)+4H2O(g) ΔH=-641.6 kJ‧mol-1
难度: 中等查看答案及解析
-
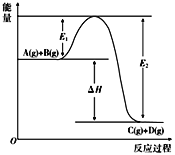
对于恒定容积的密闭容器中进行的反应A(s)+B(g)
2C(g) ΔH<0,平衡后只改变下列条件,有关叙述正确的是
A. 加入少量A物质,平衡正向移动,正反应速率加快
B. 加入少量B物质,平衡正向移动,逆反应速率减小
C. 充入氩气(不参加反应),平衡逆向移动,逆反应速率加快
D. 升高温度,平衡逆向移动,正反应速率和逆反应速率都加快
难度: 中等查看答案及解析
-
室温下,某溶液中由水电离出的OH-物质的量浓度为1×10﹣13 mol‧L-1,该溶液中一定不能大量共存的是
A.
B. Fe3+ C.
D.
难度: 中等查看答案及解析
-
常温下,将下列物质的稀溶液(浓度均为0.1mol·L-1)加热使溶液温度升高到45℃(忽略溶液体积变化),溶液的pH不变的是
A. KCl溶液 B. H2SO4溶液 C. NH4Cl溶液 D. NaOH溶液
难度: 中等查看答案及解析
-
T℃时,三种酸的电离平衡常数如下表,下列判断不正确的是
酸
HX
HY
HZ
电离平衡常数
1×10-2
9×10-6
9×10-7
A. T℃时,酸性:HX>HY>HZ
B. T℃时,反应HX+Y—=HY+X—能够发生
C. T℃时,0.1mol‧L-1的NaX、NaY、NaZ溶液,NaZ溶液pH最大
D. T℃时,0.1mol‧L-1HX溶液加水稀释HX的电离平衡常数增大
难度: 中等查看答案及解析
-
关于下列四个图象的说法中不正确的是

A. 图①可表示可逆反应:CO(g)+H2O(g)
CO2(g)+H2(g) ΔH<0
B. 图②表示用惰性电极电解足量氯化钠溶液时,两极产生的气体物质的量相等
C. 图③可表示可逆反应:A2(g)+3B2(g)
2AB3(g) ΔH >0
D. 图④可表示压强对可逆反应:2A(g)+B(g)
3C(g)+D(s)的影响,且乙压强大
难度: 中等查看答案及解析
-
化学用语是学习化学的重要工具。下列描述正确的是
A. 电解氯化钠溶液可制备金属钠
B. 氢氧燃料(碱性)电池的正极反应式是:O2+2H2O+4e-=4OH-
C. 粗铜精炼时,纯铜应与电源正极相连,其电极反应式是:Cu-2e-=Cu2+
D. 钢铁发生电化学腐蚀时,正极反应式是:Fe-2e-=Fe2+
难度: 中等查看答案及解析
-
对于可逆反应:A(g)+3B(g)
C(g) ΔH<0,下列各图正确的是

A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列事实不能用勒夏特列原理解释的是
A. 硫酸工业中使用五氧化二钒做催化剂
B. 实验室利用排饱和食盐水的方法来收集氯气
C. 工业合成氨,采用高压条件
D. 保持恒温恒容,反应2HI(g)
H2(g)+I2(g)平衡后,加入氢气体系颜色变浅
难度: 中等查看答案及解析
-
下列事实与盐类水解无关的是
A. 热的纯碱溶液去污能力增强 B. NaHSO4溶液显酸性
C. 明矾用作净水剂 D. 泡沫灭火器使用中产生大量泡沫
难度: 中等查看答案及解析
-
下列说法正确的是
A. 反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的ΔH<0
B. 浓度和体积均相同的盐酸和醋酸分别中和氢氧化钠,醋酸消耗氢氧化钠多
C. 若在海轮外壳上附着一些铜块,可以减缓海轮外壳的腐蚀
D. 25℃时,pH=3的醋酸加水稀释100倍后,溶液的pH=5
难度: 中等查看答案及解析
-
将0.1 mol‧L-1 Na2CO3溶液与0.1 mol‧L-1盐酸等体积混合,下列关系正确的是
A. c ( Na+ )> c(
) > c(H+) > c(
)> c(OH-)
B. c( Na+ )+c(H+)=c(
)+2c(
)+c(OH-)
C. c( Na+ )=c(
)+2C(
)+c(H2CO3)
D. c(OH-)+c(
)=c(H2CO3)+c(H+)
难度: 中等查看答案及解析