-
化学与社会、生产、生活、环境等密切相关,下列说法正确的是( )
A.氟利昂作制冷剂会加剧雾霾天气的形成
B.计算机芯片的材料是二氧化硅
C.汽车尾气中含有的氮氧化物,是汽油不完全燃烧造成的
D.利用二氧化碳制造全降解塑料,可以缓解温室效应
难度: 中等查看答案及解析
-
下列有关物质分类说法正确的是( )
A.钠、镁、铁对应的氧化物都是碱性氧化物
B.食醋、纯碱、食盐分别属于酸、碱、盐
C.生铁、不锈钢、青铜都属于合金
D.明矾、小苏打、水玻璃、次氯酸均为电解质
难度: 中等查看答案及解析
-
下列有关化学用语表示正确的是( )
A.HClO的结构式:H—Cl—O
B.氨气分子的比例模型

C.原子核内有10个中子的氧原子:18O
D.H2与H+互为同位素
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.标准状况下,2.24 L SO3含有分子的数目为0.1NA
B.1 mol O2与Na完全反应,转移电子数一定为4NA
C.常温常压下,1.6 g CH4中含有共价键的数目为0.4NA
D.将2 mL 0.5 mol/L硅酸钠溶液滴入盐酸中制得硅酸胶体,所含胶粒数目为0.001NA
难度: 中等查看答案及解析
-
下列有关物质的性质和应用对应正确的是( )
A.炭在常温下化学性质不活泼,因此在埋木桩前,可将埋入地下的一段表面用火微微烧焦
B.碳酸钠的水溶液呈碱性,医学上能用于治疗胃酸过多
C.盐酸与苛性
钠可自发进行反应,该反应可以设计成原电池
D.次氯酸具有强氧化性,可以起到除去水中悬浮的杂质和杀菌消毒作用
难度: 中等查看答案及解析
-
下列有关实验操作说法中,正确的是( )
A.配置1 L0.1 mol/L NaCl 溶液的实验中,用托盘天平称取 5.85g NaCl
B.用广泛pH试纸测得橙汁
pH为3.50
C.用酸式滴定管量取25.00 mL高锰酸钾溶液
D.可用过滤的方法除去淀粉溶液中混有的少量NaCl杂质
难度: 中等查看答案及解析
-
在防止禽流感疫情时,防疫部门使用了大量含氯类消毒剂,其中的一氯胺(NH2Cl)是一种长效缓释有机氯消毒剂,能水解生成具有强氧化性的物质,其杀菌能力是一般含氯消毒剂的4~5倍。下列有关一氯胺的说法正确的是( )
A.一氯胺中氯元素的化合价为-1价
B.一氯胺水解的产物为NH2OH(羟氨)和HCl
C.一氯胺起消毒作用的物质与漂白粉起消毒作用的物质相同
D.一氯胺的摩尔质量为51.5
难度: 中等查看答案及解析
-
一定条件下,下列各组物质中,Y既能与X反应又能与Z反应的是( )
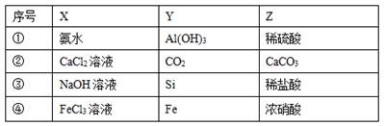
A.① B.② C.③ D.④
难度: 中等查看答案及解析
-
下列离子在指定溶液中一定能大量共存的是( )
A.能使甲基橙变红的溶液中:Fe2+、Al3+、NO3—、Cl—、S2—
B.在pH=11的溶液中:Na+、AlO2—、NO3—、S2-、SO3
2—
C.室温下,由水电离的c(H+)=10-10mol/L的溶液中:Cl—、HCO3—、NO3—、NH4+、F—
D.0.1 mol·L-1 FeCl3溶液中: K+、Na+、AlO2—、SCN—
难度: 中等查看答案及解析
-
根据下列化学实验事实得出的结论一定正确的是( )
A.向某无色溶液中先加入氯化钡溶液,生成白色沉淀,再加入足量盐酸,沉淀不溶解。结论:该溶液中含有SO42-
B.向某无色溶液中加入足量盐酸,产生能使澄清石灰水变浑浊的气体。结论:该溶液中含有CO32—或HCO3—
C.向1 mL浓度均为0.05 mol/L的NaCl、NaI混合溶液中滴加2滴0.01 mol /L的AgNO3溶液,振荡,沉淀呈黄色。结论:Ksp(AgCl)<Ksp(AgI)
D.向某无色溶液中加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝。结论:该溶液中有NH4+
难度: 中等查看答案及解析
-
某溶液中可能含有Na+、Fe2+、Br-、CO32-、I-、SO32-六种离子中的几种。①在该溶液中滴加足量氯水后,有气泡产生、溶液呈橙黄色;②向呈橙黄色的溶液中加入BaCl2溶液时无沉淀生成;③向淀粉溶液中滴加橙黄色溶液未变蓝色。根据上述实验事实推断,在该溶液中肯定存在的离子组是( )
A.Na+、Br-、CO32- B.Na+、 I-、SO32-
C.Fe2+、I-、SO32- D.Fe2+、Br-、CO32-
难度: 困难查看答案及解析
-
下列叙述不正确的是( )
①热稳定性:H2O>HF>H2S
②熔点:Al>Na>K
③第ⅠA、ⅡA族元素的阳离子与同周期稀有气体元素的原子具有相同的核外电子排布
④元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素
⑤沸点:NH3<PH3<AsH3
⑥已知2H2(g)+O2(g)=2H2O(l) △H=﹣571kJ·mol﹣1,则氢气的燃烧热为285.5kJ·mol﹣1
⑦因为常温下白磷
可自燃,而氮气须在放电时才与氧气反应,所以非金属性:P>N
A.②④⑥ B.①③⑤⑦ C.②④⑥⑦ D.①⑤⑥⑦
难度: 中等查看答案及解析
-
下列离子方程式正确的是( )
A.0.01mol/L NH4Al(SO4)2溶液与0.02mol/L Ba(OH)2溶液等体积混合
NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3·H2O
B.FeCl2酸性溶液放在空气中变质:2Fe2++4H++O2===2Fe3++2H2O
C.用CH3C
OOH溶解CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑
D.电解MgCl2水溶液的离子方程式:2Cl-+2H2O
H2↑+Cl2↑+2
OH-
难度: 困难查看答案及解析
-
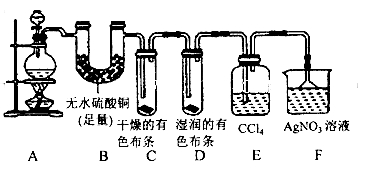
实验是化学研究的基础,关于下列各实验装置图的叙述中,正确的是( )
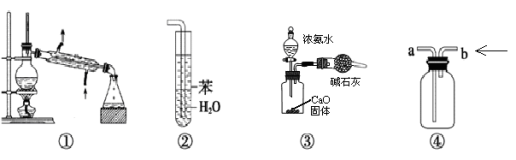
A.装置①常用于分离互不相溶的液体混合物
B.装置②可用于吸收氨气,且能够防止倒吸
C.装置③可用于制备少量NH3
D.装置④可用于收集O2
难度: 中等查看答案及解析
-
反应A+B →C分两步进行:①A+B→X,②X →C,反应过程中能量变化如图所示,E1表示反应A+ B→X的活化能。下列有关叙述正确的是( )
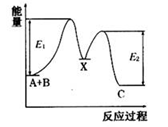
A.E2表示反应X→C的活化能
B.X是反应A+B→C的催化剂
C.反应A+B→C的△H<0
D.加入催化剂可改变反应A+B→C的焓变
难度: 中等查看答案及解析
-
常温下,有下列四种溶液:①pH=2的HCl溶液;②pH=2的CH3COOH溶液;③pH=12的NaOH溶液;④pH=12的氨水。下列有关说法不正确的是( )
A.四种溶液中的KW相同,由水电离出的c(H+):①=②=③=④
B.取体积相同的溶液①、②、③分别与足量铝粉反应,生成H2的量:①最少
C.将等体积的四种溶液分别稀释100倍,所得溶液的pH:③>④>②>①
D.常温下,将②和③等体积混合:c(CH3COO-)-c(Na+)=c(H+)-c(OH-)
难度: 困难查看答案及解析
-
X、Y、Z、W均为短周期元素,它们在周期表中相对位置如下图所示。若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )
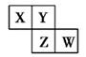
A.四种元素的单质中,Z的熔沸点最低
B.最高价氧化物对应水化物的酸性W比Z弱
C.Y的气态氢化物的稳定性较Z的弱
D.离子半径:Z> W>X>Y
难度: 中等查看答案及解析
-
向CuSO4溶液中逐滴加入 KI溶液至过量,观察到产生白色沉淀CuI,溶液变为棕色。再向反应后的混合物中不断通人 SO2气体,溶液逐渐变成无色。下列分析正确的是( )
A.滴加KI溶液时,转移2 mol e— 时生成 1 mol白色沉淀
B.通入SO2后溶液逐渐变成无色,体现了 SO2的漂白性
C.通入SO2时,SO2与I2反应,I2作还原剂
D.上述实验条件下,物质的氧化性:Cu2+ >I2 > SO2
难度: 困难查看答案及解析
-
下列说法正确的是( )
A.常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s)能自发进行,则△H<0
B.铁片镀锌时,铁片与外电源的正极相连
C.以熔融NaCl为电解质进行电解冶炼钠,熔融体中Na+向阳极移动
D.t℃时,恒容密闭容器中反应:NO2(g)+SO2(g)
NO(g)+SO3(g),通入少量O2,
的值及SO2转化率不变
难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.将CO2通入BaCl2溶液中至饱和,无沉淀产生;再通入SO2,产生沉淀
B.在稀硫酸中加入铜粉,铜粉不溶解;再加入Cu(NO3)2固体,铜粉仍不溶解
C.向AlCl3溶液中滴加氨水,产生白色沉淀;再加入过量NaHSO4溶液,沉淀消失
D.纯锌与稀硫酸反应产生氢气的速率较慢;再加入少量CuSO4固体,速率不改变
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.0.1 mol·L-1 Na2CO3溶液中:c(HCO3-)=2c(H2CO3)+c(H+)-c(OH-)
B.物质的量浓度相等的Na2SO3和NaHSO3溶液中:3c(Na+)=2[c(HSO3-)+c(H2SO3)+c(SO32—)]
C.同浓度的下列溶液中,① NH4HSO4 ② NH4Cl ③ NH3·H2O,c(NH4+)由大到小的顺序是:
②>①>③
D.常温下,浓度均为0.1mol/L NaA和HA溶液中pH=8:c(HA)>c(Na+)> c(A—)> c(OH—)> c(H+)
难度: 困难查看答案及解析
-
已知:①CH3OH(g) +3/2O2(g)=CO2(g)+2H2O(g) △H=-akJ·mol一1
②CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-bkJ·mol一1
③CH4(g)+2O2(g)=CO2(g)+2H2O(1) △H=-ckJ·mol一1
则下列叙述正确的是( )
A.由上述热化学方程式可知b>c
B.甲烷的燃烧热为bkJ/mol
C.2CH3OH(g)=2CH4(g) +O2(g) △H=2(b一a)KJ∙ mol一1
D.当甲醇和甲烷物质的量之比为1:2时,其完全燃烧生成CO2和H2O(1)时,放出的热量为Q kJ,则该混合物中甲醇的物质的量为Q/(a+2b) mol
难度: 困难查看答案及解析
-
向18.4g铁和铜组成的合金中加入过量的硝酸溶液,合金完全溶解,同时生成NO2、NO混合气体,再向所得溶液中加入足量的NaOH溶液,生成30.3g沉淀.另取等质量的合金,使其与一定量的氯气恰好完全反应,则氯气的体积在标准状况下为( )
A.7.84L B.6.72L C.4.48L D.无法计算
难度: 困难查看答案及解析
-
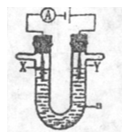
利用如图所示原电池可测量空气中Cl2含量,其中电解质是Ag+可以自由移动的固体物质。
下列分析不正确的是( )

A.电子经外电路流向Pt电极
B.电池工作时,电解质中Ag+数目减少
C.正极反应:Cl2+2e—+2Ag+ = 2AgCl
D.空气中c(Cl2)越大,Ag极消耗速率越快
难度: 困难查看答案及解析
-
下图所示与对应叙述相符的是( )
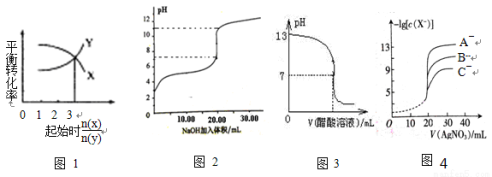
A.一定条件下,X和Y反应生成Z,由图1推出该反应的方程式可表示为:X + 3Y
Z
B.图2表示NaOH溶液滴加到0.1 mol/L的一元酸溶液得到的滴定曲线(常温下),该实验最好选取酚酞作指示剂
C.常温下,向NaOH溶液中逐滴加入等浓度的醋酸溶液,所得滴定曲线如图3所示。当7<pH<13时,溶液中c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.用硝酸银溶液滴定等浓度的A-、B-、C-的混合溶液(均可以与Ag+反应生成沉淀),由图4可确定首先沉淀的是C-
难度: 困难查看答案及解析