-
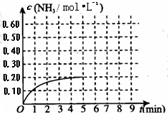
某温度时,在一容积为1L的密闭容器中,加入0.4mol的N2和1.2mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)⇌2NH3(g)△H<0,5min时达到平衡,反应中NH3的物质的量浓度的变化情况如图所示:请回答下列问题:(1)根据上图,计算从反应开始到平衡时,平均反应速率v(N2)=______.
(2)该反应的化学平衡常数表达式为______.
(3)反应达到平衡后,第5min末保持其他条件不变,若改变反应温度,则NH3的物质的量浓度不可能为______(填序号)
a.0.82mol•L-1 b.0.25mol•L-1 c.0.20mol•L-1 d.0.08mol•L-1
(4)反应达到平衡后,第5min末保持其他条件不变,若只把容器的体积缩小一半,平衡______移动(填“向右”、“向左”或“不”),化学平衡常数______(填“增大”、“减少”或“不变”).
(5)其它条件不变,在第5min末将容器的体积缩小一半,若第8min达到新的平衡(此时NH3的物质的量约为0.25mol),请在上图中画出第5min末到此平衡时NH3物质的量浓度的变化曲线.
-
在一容积为4 L的密闭容器中,加入0.4mol的N2和1.2mol的H2,在一定条件下发生如下反应:
N2(g)+3H2(g) 2NH
2NH 3(g ) △H<0,反应中NH3的物质的量浓度变化情况如右图:
3(g ) △H<0,反应中NH3的物质的量浓度变化情况如右图:
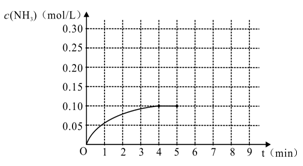
(1)根据上图,计算从反应开始到平衡时,平均反应速率v(H2)为____________mol/(L·min)。
(2)该反应的化学平衡常数表达式K_____________,随温度的升高,K值将 (填“增大”、“减小”“不变”)
(3)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则 NH3的物质的量浓度不可能为______________。
NH3的物质的量浓度不可能为______________。
A. 0.20 mol/L B. 0.12 mol/L C. 0.10 mol/L D. 0.08 mol/L
(4)反应达到平衡后,第5分钟末,保持其它条件不变,若只把容器的体积缩小一半,平衡___________________移动(填“向逆反应方向”、“向正反应方向”或“不”),化学平衡常数___________(填“增大”、“减小”或“不变”)。
(5)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25 mol/L),请在上图中画出第5分钟末到此平衡时NH3浓度的变化曲线。
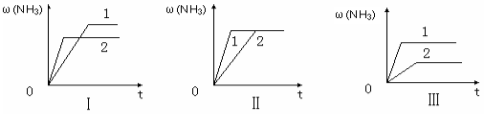
(6)在三个 相同容器中各充入1 molN2和3molH2,在某一不同条件下反应并达到平衡,氨的体积分数随时间变化曲线如下图。下列说法正确的是 (填序号) 。
相同容器中各充入1 molN2和3molH2,在某一不同条件下反应并达到平衡,氨的体积分数随时间变化曲线如下图。下列说法正确的是 (填序号) 。
A.图Ⅰ可能是不同压强对反应的影响,且P2>P1
B.图Ⅱ可能是不同压强对反应的影响,且P1>P2
C.图Ⅲ可能是不同温度对反应的影响,且T1>T2
D.图Ⅱ可能是同温同压下,催化剂性能对反应的影响,且1>2
-
恒温条件下,往容积为2L的密闭容器内加入0.4 mol的N2和一定量的H2,在一定条件下发如下反应: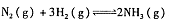 ,反应中NH3物质的量变化情况如下图:下列说法合理的是
,反应中NH3物质的量变化情况如下图:下列说法合理的是
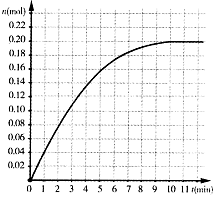
A.反应前l0min反应速率
B.N2平衡转化率为50%
C.若平衡时气体总压强为开始时的80%,则12min时氨气的体积分数为25%
D.其它条件不变,若改用5L容器达到平衡需
要的时间将小于l0min
-
一定温度下,在三个容积相同的恒容密闭容器中按不同方式投入反应物,发生反应3H2(g)+N2(g)⇌2NH3(g) ΔH=-92.4 kJ·mol-1,测得反应的相关数据如下:
| 容器1 | 容器2 | 容器3 |
| 反应温度T/K | 500 | 500 | 300 |
| 反应物投入量 | 3 mol H2、1 mol N2 | 4 mol NH3 | 2 mol NH3 |
| 平衡v正(N2)/mol·L-1·s-1 | v1 | v2 | v3 |
| 平衡c(NH3)/mol·L-1 | c1 | c2 | c3 |
| 平衡体系总压强p/Pa | p1 | p2 | p3 |
| 达到平衡时能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
| 达到平衡时体积分数 | φ1(NH3) | φ2(NH3) | φ3(NH3) |
| 物质的平衡转化率α | α1(H2) | α2(NH3) | α3(NH3) |
| 平衡常数K | K1 | K2 | K3 |
下列说法正确的是( )
A. v1<v2,c2>2c1 B. K1=K2,p2>2p1
C. φ1(NH3)<φ3(NH3),a+0.5b<92.4 D. c2>2c3,α1(H2)+α3(NH3)>1
-
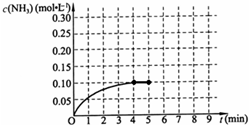
在一容积为2L的密闭容器中,加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)⇌2NH3(g)△H<0;反应中NH3的物质的量浓度的变化情况如图所示,请回答下列问题:
(1)根据右图,计算从反应开始到平衡时,平均反应速率v(NH3)为______.
(2)该反应到平衡时H2的转化率是______.
(3)若容器容积不变,下列措施可增加NH3产率的是______.
A.升高温度 B.将NH3(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入0.2molN2和0.6molH2
(4)反应达到平衡后,第5分钟末,保持其它条件不变,若只把容器的体积缩小一半,平衡向______移动(填“向逆反应方向”、“向正反应方向”或“不”),化学平衡常数______(填“增大”、“减少”或“不变”).
-
在一固定容积为2L的密闭容器内加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g) 2NH3(g) △H<0 。反应中NH3的物质的量浓度的变化情况如下图所示,请回答下列问题:
2NH3(g) △H<0 。反应中NH3的物质的量浓度的变化情况如下图所示,请回答下列问题:
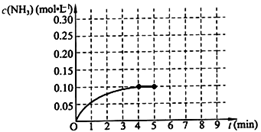
根据图,计算从反应开始到平衡时,平均反应速率v(NH3)=________。
⑵下列描述中能说明上述反应已达平衡的是________。
A.3v正(H2)=2v逆(NH3)
B.容器中气体的平均相对分子量不随时间而变化
C.容器中气体的密度不随时间而变化
D.容器中气体的分子总数不随时间而变化
⑶ 第5分钟末,保持恒温恒压,若继续通入0.2mol的N2和0.6mol的H2,平衡________移动(填“向正反应方向”、“向逆反应方向”或“不”)。
-
在一容积为2 L的密闭容器内加入0.2 mol 的N2和0.6 mol 的H2,在一定条件下发生如下反应:N2(g)+3H2(g) 2NH3(g) △H<0,反应中NH3的物质的量浓度的变化的情况如右图:
2NH3(g) △H<0,反应中NH3的物质的量浓度的变化的情况如右图:

(1)根据右图,计算从反应开始到平衡时,平均反应速率v(NH3)为_________________。
(2)该反应的化学平衡常数表达式K=___________________。
(3)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为________。
a. 0.20 mol/L b. 0.12 mol/L c. 0.10 mol/L d. 0.08 mol/L
(4)反应达到平衡后,第5分钟末,保持其它条件不变,若只把容器的体积缩小一半,平衡_________________________移动(填“向逆反应方向”、“向正反应方向”或“不”),化学平衡常数________________(填“增大”、“减小”或“不变”)。
(5)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25 mol/L)。请在上图中画出第5分钟末到此平衡时NH3浓度的变化曲线。___________________
-
(10分)在一固定容积为2L的密闭容器内加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g) 2NH3(g) △H<0 。反应中NH3的物质的量浓度的变化情况如下图所示,请回答下列问题:
2NH3(g) △H<0 。反应中NH3的物质的量浓度的变化情况如下图所示,请回答下列问题:
⑴ 根据下图,计算从反应开始到平衡时,平均反应速率v(NH3)=______________________________
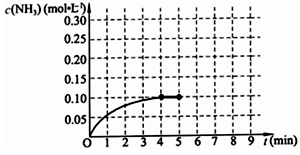
⑵ 该反应450℃的平衡常数________500℃时的平衡常数(填“>”、“<”或“=”)。
⑶ 下列描述中能说明上述反应已达平衡的是___________。
A.3v正(H2)=2v逆(NH3)
B.容器中气体的平均相对分子量不随时间而变化
C.容器中气体的密度不随时间而变化
D.容器中气体的分子总数不随时间而变化
⑷ 第5分钟末,保持恒温恒压,若继续通入0.2mol的N2和0.6mol的H2,平衡_______________移动(填“向正反应方向”、“向逆反应方向”或“不”)。
⑸ 第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH3浓度约为0.25mol/L),请在上图中画出第5分钟末到此平衡时NH3浓度的变化曲线。
-
(10分)在一固定容积为2L的密闭容器内加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g) 2NH3(g) △H<0 。反应中NH3的物质的量浓度的变化情况如下图所示,请回答下列问题:
2NH3(g) △H<0 。反应中NH3的物质的量浓度的变化情况如下图所示,请回答下列问题:
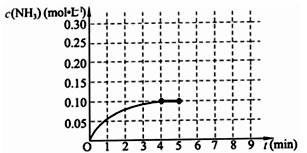
⑴ 根据上图,计算从反应开始到平衡时,平均反应速率v(NH3)=_________________。
⑵ 该反应450℃的平衡常数________500℃时的平衡常数(填“>”、“<”或“=”)。
⑶ 下列描述中能说明上述反应已达平衡的是___________。
A.3v正(H2)=2v逆(NH3)
B.容器中气体的平均相对分子量不随时间而变化
C.容器中气体的密度不随时间而变化
D.容器中气体的分子总数不随时间而变化
⑷ 第5分钟末,保持恒温恒压,若继续通入0.2mol的N2和0.6mol的H2,平衡_______________移动(填“向正反应方向”、“向逆反应方向”或“不”)。
⑸ 第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH3浓度约为0.25mol/L),请在上图中画出第5分钟末到此平衡时NH3浓度的变化曲线。
-
(10分)在一固定容积为2L的密闭容器内加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生如下反应: N2(g)+3H2(g) 2NH3(g) △H <0
2NH3(g) △H <0
(1)该反应450℃的平衡常数________500℃时的平衡常数(填“>”、“<”或“=”);
(2)下列描述中能说明上述反应已达平衡的是________
a.3v正(H2)=2v逆(NH3) b.容器中气体的平均相对分子量不随时间而变化
c.容器中气体的密度不随时间而变化 d.容器中气体的分子总数不随时间而变化
(3)上述反应若第5分钟时达到平衡,测得NH3的物质的量为0.2mol
计算从反应开始到平衡时,平均反应速率v(N2)为________mol/(L·min)
(4)保持其他条件不变,若初始投入量为a molN2、b molH2 、c molNH3,也可得到与上述相同的平衡,则a、b、c需满足关系式:________ ________ ;
(5)第5分钟末,保持其它条件不变, 若继续通入0.2 mol的N2和0.6 mol的H2,
则平衡________移动(填“向正反应方向”“向逆反应方向”或“不”)。
2NH
3(g ) △H<0,反应中NH3的物质的量浓度变化情况如右图:

NH3的物质的量浓度不可能为______________。
相同容器中各充入1 molN2和3molH2,在某一不同条件下反应并达到平衡,氨的体积分数随时间变化曲线如下图。下列说法正确的是 (填序号) 。


 ,反应中NH3物质的量变化情况如下图:下列说法合理的是
,反应中NH3物质的量变化情况如下图:下列说法合理的是




